
科目: 来源:09~10年江西四校高二下学期期中联考化学卷 题型:填空题
(6分)如图所示,600K时,在容积可变的透明容器内,反应2HI(气) I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。
I2(气)+H2(气)达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示观察方向__▲__(填“能”或“不能”)看出两次平衡时容器内颜色深浅的变化,理由是_▲__。若从水平方向观察,能否看到容器内颜色深浅的变化__▲___。
查看答案和解析>>
科目: 来源:09~10年建湖二中高二下学期期末考试化学卷 题型:填空题
(12分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如: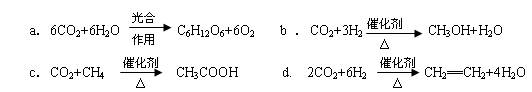
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。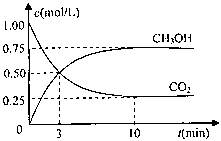
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 ,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |

查看答案和解析>>
科目: 来源:09~10年长沙同升湖实验学校高二下学期期末考试化学卷 题型:填空题
(12分)t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白:
xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成B的平均反应速率为 。
(2)x= ,平衡常数K= 。
( 3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) 。
3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) 。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
查看答案和解析>>
科目: 来源:2010年四川省眉山中学高二下学期期末教学质量检测(理综)化学部分 题型:填空题
(15分)向一个体积可变的密闭器中充入4molA、1molB,发生如下反应:
4A(g)+B(s)  3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率 ,容器中D的体积分数 。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是 L。
查看答案和解析>>
科目: 来源:2010年河南省焦作市高一下学期期末测试化学(必修2)试题 题型:填空题
(7分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式为: ;
(2)反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是: 。
查看答案和解析>>
科目: 来源:09-10年湖北潜江文昌高中高一下学期期末总复习化学试题 题型:填空题
(10分)可逆反应2SO2 + O2  2SO3进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题:
2SO3进行的时间(t)和反应混合气中SO3的百分含量的关系如图所示。请回答下列问题:
(1)如果两条曲线为其它条件相同,分别为使用和不使用催化剂,则曲线 表示使用了催化剂,并且从图象可知,催化剂可以 但不能
(2)请你再提出能增大该反应反应速率的两条措施 和 。
查看答案和解析>>
科目: 来源:09~10学年浠水一中高二下学期期中考试化学卷 题型:填空题
(10分)接触法制硫酸的核心反应是2SO2(g) + O2(g) 2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
(1) 0min~4min内生成O2平均速率v(O2)= ;如果0min~4min内SO3生成速率平均为x,4min~8min内SO3生成速率平均为y,8min~10min内SO3生成速率平均为z(其它条件不变,且忽略反应中温度变化),则x、y、z大小关系为______________。
(2) 达到平衡时c(O2)=c(SO2),则a= mol·L-1;如果此时在平衡体系中加入0.5molN2,则SO2在混合气中所占的体积分数____________(填“增大”、“减小”或“不变”)
(3) 若起始时n(SO3)、n(SO2)、n(O2)(/mol)分别按下列4组数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是 。
| A.1、2、2 | B.3、1.5、1 | C.3、0、0 | D.0、6、5 |
查看答案和解析>>
科目: 来源:09~10学年江苏宿迁中学高二下学期期中考试化学卷 题型:填空题
(12分)在密闭容器中,保持一定温度进行如下反应N2(g)+3H2(g) 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填字母序号)。
| A.N2的转化率越高 | B.NH3的产量越大 |
| C.正反应进行得越彻底 | D.化学反应速度越快 |
| 状态 条件 | 起始时物质的物质的量(mol) | 平衡时NH3的物质的量 (mol) | |||
| 编号 | X(N2) | Y(H2) | Z(NH3) | ||
| 恒容 | ① | 1 | 3 | 0 | b |
| ② | 0 | 0 | | b | |
| ③ | | 2.25 | | b | |
查看答案和解析>>
科目: 来源:09~10学年浙江舟山七校高二下学期期末考试化学试题 题型:填空题
(11分)如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:A(g) + 3B(g)  2C(g)
2C(g)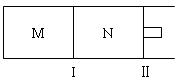
(1)向M、N中,各通入1mol A和3mol B。初始M、N容积相同,并保持温度不变。则到达平衡时A的转化率α(A)M α(A)N A的体积分数x(A)M x(A)N
(2))向M、N中,各通入x molA和y molB,初始M、N容积相同,并保持温度不变。若要平衡时保持A气体在M、N两容器中的体积分数相等,则起始通入容器中的A的物质的量xmol与B的物质的量ymol之间必须满足的关系式为
(3)若在某件下,反应A(g) + 3B(g)  2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为 ;保持温度和压强不变,向此容器内通入0.36mol A,平衡将 (填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由
2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为 ;保持温度和压强不变,向此容器内通入0.36mol A,平衡将 (填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由
。
查看答案和解析>>
科目: 来源:09—10学年辽中第一私立高一下学期期末考试化学试题 题型:填空题
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空: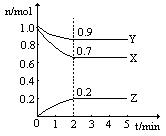
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时:
此时体系的压强是开始时的 倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com