
科目: 来源:2011-2012学年广东省梅州市曾宪梓中学高二上学期中考试理综试题(化学部分) 题型:填空题
(20分)在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO |
| C.使用高效催化剂 | D.升高温度 |

查看答案和解析>>
科目: 来源:2011-2012学年广东省梅州市曾宪梓中学高二上学期中考试理综试题(化学部分) 题型:填空题
(14分)某化学反应2A B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率V(B)为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
查看答案和解析>>
科目: 来源:2011-2012学年山西省高三上学期第二次阶段性测试化学试卷 题型:填空题
(11分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下:
请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
(填字母)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(CO)=c(CH3OH) d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式: 。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是 。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为 。
(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛 g(精确到0.1,下同),甲醇厂CO的转化率为 。
查看答案和解析>>
科目: 来源:2011-2012学年甘肃省兰州一中高二上学期期中考试化学(理)试卷 题型:填空题
(8分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏 特列原理。请回答下列问题。
特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 4C(g)
4C(g) 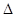 H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
①增加C的物质的量 ②加 压 ③升 温 ④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)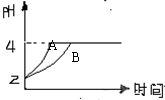
查看答案和解析>>
科目: 来源:2011-2012学年甘肃省兰州一中高二上学期期中考试化学(理)试卷 题型:填空题
(10分)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0 试回答下列问题:
CO2(g)+H2(g) △H<0 试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L -1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=
-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=
(2)在相同温度下,起始物质按下列四种配比充入该容器中,c(H2O)=2mol·L-1,c(CO)
=c(CO2)="1" mol·L-1, c(H2)="1.5" mol·L-1,则此时该反应是否达到平衡状态 (选填“是”与“否”),此时v正 v逆(选填“ 大于”、“小于”或“等于”)。
大于”、“小于”或“等于”)。
(3)平衡时若降低温度,该反应的K值将 (选填“增 大”、“减小”或“不变”),
大”、“减小”或“不变”),
平衡 移动(选填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目: 来源:2011-2012年广东省汕头市金山中学高二上学期期中考试化学试卷(理科) 题型:填空题
(6分)可逆反应①X(g)+2Y(g) 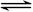 2Z(g) 、②2M(g)
2Z(g) 、②2M(g) 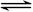 N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: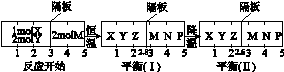
则X(g)+2Y(g) 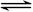 2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
查看答案和解析>>
科目: 来源:2012届广东省潮汕两市名校高三上学期期中联考理综试题(化学部分) 题型:填空题
(16分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)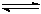 CH3OH(g)。图1表
CH3OH(g)。图1表 示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。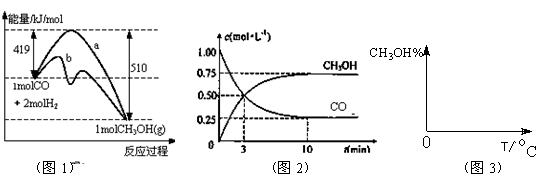
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
| A.起始充入的CO为2mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
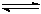 CH3OH(g)的化学平衡常数为______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______________ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。查看答案和解析>>
科目: 来源:2011—2012学年辽宁省沈阳二中高二上学期10月月考化学试卷 题型:填空题
(6分)在一个容积不变的反应容器中,可以通过调节温度使下列反应:A(g)+2B(g) 2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
2C(g) 达到平衡时保持容器内气体的总物质的量为15 mol。现向反应容器中加6.5 mol A、X mol B、4 mol C。
(1)若X=5.5时需要降低体系温度才能使反应达平衡时符合题设条件,则正反应为_________反应。(填“吸热”或“放热”)
(2)欲使该反应起始时维持逆向移动,则X的取值范围_________________________。
查看答案和解析>>
科目: 来源:2011—2012学年辽宁省沈阳二中高二上学期10月月考化学试卷 题型:填空题
(10分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1
SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。(3分)
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。(3分)
查看答案和解析>>
科目: 来源:2011—2012学年辽宁省沈阳二中高二上学期10月月考化学试卷 题型:填空题
(7分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。
实验步骤:将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.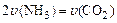 | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com