
科目: 来源:2011-2012年广西北海合浦县教育局教研室高二上学期期中考试化学(理)试卷 题型:填空题
在密闭容器中进行可逆反应:CO (g)+NO2 (g) 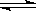 CO2 (g) + NO (g)(正反应为放热反应),达到平衡后,只改变其中一个条件,对平衡的影响是:(填“向左”、“向右”、“不移动”或颜色“变深”、“变浅”或“不变化”)
CO2 (g) + NO (g)(正反应为放热反应),达到平衡后,只改变其中一个条件,对平衡的影响是:(填“向左”、“向右”、“不移动”或颜色“变深”、“变浅”或“不变化”)
(1)增大容器的体积,平衡____________,反应混合物的颜色____________;
(2)通入CO2气体,平衡____________,反应混合物颜色_______________;
(3)升高温度,平衡_______________,反应混合物的颜色____________;
(4)加入一定量的N2,平衡____________,反应混合物的颜色___________;
(5)加入催化剂,平衡________________。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省泗县双语中学高二第二次月考理科综合试题(化学部分) 题型:填空题
(12分)在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A (g)+3B(g) 2C(g) +2D(g),2 min 末反应达到平衡状态,生成0.8 mol D,请填写下面空白:
2C(g) +2D(g),2 min 末反应达到平衡状态,生成0.8 mol D,请填写下面空白:
(1)B的平衡浓度为 。
(2)A的转化率为 。
(3)用D表示的平均反应速率为 。
(4)如果缩小反应容器容积(温度不变),使压强增大,则平衡体系中C的物质的量浓度 ,C的质量分数 ,混合气体平均相对分子质量 (均填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省泗县双语中学高二第二次月考理科综合试题(化学部分) 题型:填空题
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: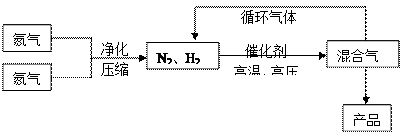
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -1 95.79 95.79 | -259.23 | -33.42 |
 (1)操作的目的:
(1)操作的目的:  2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是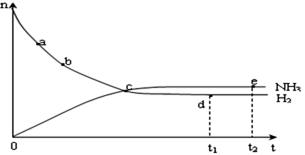
查看答案和解析>>
科目: 来源:2011-2012学年安徽省泗县双语中学高二第二次月考理科综合试题(化学部分) 题型:填空题
(19分)高炉炼铁中发生的基本反应之一如下:FeO(s)+ CO (g)  Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0
(1)此反应的平衡常数表达式为:K= ;
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比 (填“增大”、 “减小”或“不变”。);
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应 (填“是”或“不是”)处于化学平衡状态。
如果“不是”,此时化学反应向 方向进行(填“正反应”或“逆反应”)。如果“是”,此空不填。
(4)在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,发生反应2SO2+O2 2SO3经10min后反应达平衡时有3molSO3生成。试计算:
2SO3经10min后反应达平衡时有3molSO3生成。试计算:
①O2的转化率为:
②平衡常数K为:
查看答案和解析>>
科目: 来源:2012届北京市海淀区高三上学期期中练习化学试卷 题型:填空题
(12分)汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2L密闭 容器中充入N2和O2各1mol,平衡时,N2的转化率是 %
容器中充入N2和O2各1mol,平衡时,N2的转化率是 %
(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L
和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向
正反应方向进行”或“向逆反应方向进行”),理由是
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。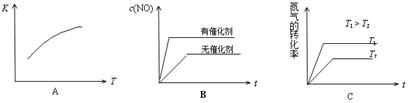
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入
一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的
体积分数 (填“变大、“变小”或“不变”)。
查看答案和解析>>
科目: 来源:2012届浙江省台州市四校高三第一次联考化学试卷 题型:填空题
(10分)、能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)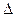 H1
H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)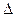 H2
H2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
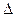 H1 0(填“>”“=”或“<”);
H1 0(填“>”“=”或“<”); 到某时刻测得各组分的浓度如下:
到某时刻测得各组分的浓度如下:| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目: 来源:2012届浙江省海盐元济高级中学高三上学期10月份月考化学试卷 题型:填空题
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
已知100℃时达到平衡所需的时间为5min,
①则用H2表示的平均反应速率为_ 。
②图中的P1_ _P2(填“<”、“>”或“=”),100℃时平衡常数为_  _。
_。
③在其它条件不变时降低温度,逆反应速率将 _ _(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的 △H_ _0,△S_ _0(填“<”、“>”或“=”)。
△H_ _0,△S_ _0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_ _。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。
| l 实验编号 | l T(℃) | l n (CO)/n(H2) | l P(MPa) |
| l ⅰ | l 150 | l 1/3 | l 0.1 |
| l ⅱ | l _ _ | l _ _ | l 5 |
| l ⅲ | l 350 | l _ _ | l 5 |

查看答案和解析>>
科目: 来源:2012届浙江省桐乡市高级中学高三上学期10月份月考化学试卷 题型:填空题
(本题14分)工业上用CO生产燃料甲醇。一定条件下发生反应: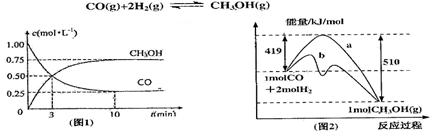
(1)图l是反应时CO和CH3OH(g)的浓度随时问变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率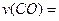 ;
;
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表使用催化剂后的能量变化。该反应的焓变是 (选填“△H<0”或“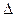 H>0”)反应,写出反应的热化学方程式 ;选择适宜的催化剂, (填“能”或“不能”)改变该反应的反应热;
H>0”)反应,写出反应的热化学方程式 ;选择适宜的催化剂, (填“能”或“不能”)改变该反应的反应热;
(3)该反应平衡常数K的表 达式为 ,温度升高,平衡常数K (填“增大”、“不变”或“减小”);
达式为 ,温度升高,平衡常数K (填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使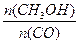 增大的 。
增大的 。
a.升高温度; b.充入He气
c.再充入1molCO和2mol H2 d.使用催化剂
查看答案和解析>>
科目: 来源:2011-2012学年河北省魏县一中高二上学期期中考试化学试卷 题型:填空题
(8分)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2 SO2 (g)+ O2(g)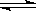 2 SO3(g) △H =" —196.0" kJ.mol-1
2 SO3(g) △H =" —196.0" kJ.mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是_____(填字母标号)。(2分)
| A.加入V2O5做催化剂 | B. 使用过量SO2 使用过量SO2 | C.高温 | D.通入过量空气 |
查看答案和解析>>
科目: 来源:2011-2012学年河北省魏县一中高二上学期期中考试化学试卷 题型:填空题
(5分)在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l) 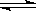 4NH3(g)+3O2(g) △H =" a" kJ.mol-1
4NH3(g)+3O2(g) △H =" a" kJ.mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下:
| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10—6mol) | 4.8 | 5.9 | 6.0 |
 g)
g) 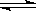 3NH3(g) △H =" —92.4" kJ.mol-1
3NH3(g) △H =" —92.4" kJ.mol-1 2N2(g) + 6H2O(l)
2N2(g) + 6H2O(l) 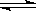 4NH3(g) + 3O2(g)△H = _________。(3分)
4NH3(g) + 3O2(g)△H = _________。(3分)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com