
科目: 来源:2012届河南省洛阳市高三“一练”考试化学试卷 题型:填空题
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为: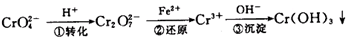
其中第①步存在平衡:
(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要 mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为 。在溶液中存在以下沉淀溶解平衡: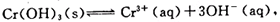 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为 ,阴极区反应式为 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。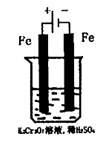
查看答案和解析>>
科目: 来源:2012届黑龙江省绥棱县第一中学高三11月月考化学试卷 题型:填空题
(11分) T ℃时,将3mol气体A和1mol气体B通入体积为2L的密闭容器内(容积不变),发生反应:3A(g)+B(g) xC(g) ,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4 mol / L.请回答下列问题:
xC(g) ,2min时反应达到平衡状态(温度不变),剩余0.8molB。并测得C的浓度为0.4 mol / L.请回答下列问题:
(1)从开始反应至平衡状态,生成C的平均反应速率为___,A的转化率为____.
(2)x=__________
(3)若继续向原平衡 状态的混合物容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡将_______(填字母,下同),若通入气体A后,化学平衡将______。
状态的混合物容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡将_______(填字母,下同),若通入气体A后,化学平衡将______。
a.向正反应方向移动
b.向逆反应方向移动
c.不移动
(4)T ℃时,向2L密闭容器中充入4mo lC,反应达到平衡时,B的物质的量为______。
lC,反应达到平衡时,B的物质的量为______。
查看答案和解析>>
科目: 来源:2011-2012学年河南省偃师市高级中学高二第二次月考化学试卷 题型:填空题
(14分)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目: 来源:2012届北京市顺义区高三尖子生综合素质展示化学试卷 题型:填空题
(14分)已知:化合物B、C、E中含有两种相同的元素,A可用于玻璃、洗涤剂等的生产,B可用于制作光纤,G的组成元素与D相同。这些化合物之间存在下图所示的转化关系。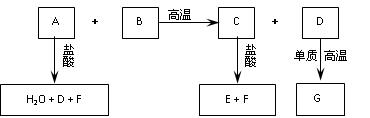
请回答:
(1)在化合物A、C、F中含有的 相同元素 。
相同元素 。
(2)化合物C的化学式为 ,其水溶液的pH 7(填“>”或“<”) 。
。
(3) 700 ℃时,向容积为 2 L的密闭容器中充入一定量的G(g)和H2O(g),发生反应:
2 L的密闭容器中充入一定量的G(g)和H2O(g),发生反应:
G(g)+H2O(g)  D(g)+H2(g)。反应过程中测定的部分数据见下表(表中t1>t2):
D(g)+H2(g)。反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(G)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省牡丹江一中高二上学期期中考试化学(理)试卷 题型:填空题
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。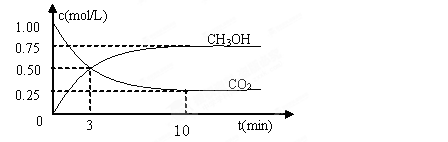
①反应开始到平衡,H2的平均反应速率v(H2)=_____mol/(L·min)。H2的转化率为 。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 H2 |
 同种物质的v正与v逆的关系: v正 v逆 (填>,=,<)
同种物质的v正与v逆的关系: v正 v逆 (填>,=,<)查看答案和解析>>
科目: 来源:2010-2011学年北京市密云二中高二下期3月份月考化学试卷 题型:填空题
工业上利用反应:CO(g)+H2O(g) 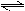 CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。
CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。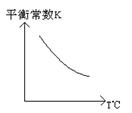
若在一容积固定的密 闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
 位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
位时间内减少CO(g)的浓度等于生成CO2(g)的浓度 __(填“增大”、“减小”或“不变”).
__(填“增大”、“减小”或“不变”). 查看答案和解析>>
科目: 来源:2010-2011学年北京市密云二中高二下期3月份月考化学试卷 题型:填空题
在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H 2 及固体催化剂,使之反应.已知:N2(g)+3H2(g)
2 及固体催化剂,使之反应.已知:N2(g)+3H2(g) 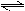 2NH3(g);△H="-92.2" kJ·mol-1.平衡时,容器内气体压强为起始时的80%.
2NH3(g);△H="-92.2" kJ·mol-1.平衡时,容器内气体压强为起始时的80%.
(1)反应达到平衡时,放出的热量_______.
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)欲使H2的转化率提高为原来的两倍,则在其他条件不变的情况下,应将N2的初始量由2mol提高至__________mol.
(3)保持同一温度,在相同的容器中,若起始时加入2molNH3、1molH2 及固体催化剂,反应达到平衡时NH3的体积分数_________.
A.等于0.25 B.大于0.25 C.小于0.25
(4)右图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线.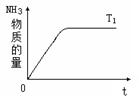
查看答案和解析>>
科目: 来源:2011-2012学年广东省培正中学高二上学期期中考试化学试卷 题型:填空题
(20分)在一容积为2 L的密闭容器内加入0.2 mol 的N2和0.6 mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为____ _。
(2)该反应的化学平衡常数表达式K=_____ 。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目: 来源:2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷 题型:填空题
(12分)化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g) 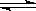 2CO(g)平衡常数K的表达式为 ;
2CO(g)平衡常数K的表达式为 ;
已知C(s) + H2O(g)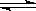 CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g) 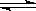 CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为 。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为 。
(2) 已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19
2SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中充入C(SO2)=1mol·L-1,C(O2)="1" mol·L -1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行。
-1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g) cC(g)+dD(g) △H = a kJ·mol-1;
cC(g)+dD(g) △H = a kJ·mol-1;
若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
查看答案和解析>>
科目: 来源:2011-2012学年河南省焦作市修武一中分校高二上学期期中考试化学试卷 题型:填空题
(10分)在温度一定的条件下,向一密闭容器中加入4mol SO2和3 mol O2,发生反应:2 SO2 (g) + O2 (g)  2 SO3 (g) △H<O,达到平衡后,生成了a mol SO3。[来源:学_科_网]
2 SO3 (g) △H<O,达到平衡后,生成了a mol SO3。[来源:学_科_网]
(1) 温度升高,该反应的化学平衡常K值___________(填增大、减小、可能增大也可能减小)。
(2)SO2的转化率为 (用字母a的表达式表示)
(3)若该反应是在恒温恒压的密闭容器中进行的。现加入8mol SO2和6mol O2,达到平衡后SO3气体的物质的量为  mol (用字母a表示)。如在同样的条件下,加入3mol SO2、3mol O2、x molSO3气体,达平衡后SO3在反应混合气中的体积分数与原平衡相同,则x= ,平衡后SO3的物质的量是 mol。(用含a的表达式表示)
mol (用字母a表示)。如在同样的条件下,加入3mol SO2、3mol O2、x molSO3气体,达平衡后SO3在反应混合气中的体积分数与原平衡相同,则x= ,平衡后SO3的物质的量是 mol。(用含a的表达式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com