
科目: 来源:2012届湖北省八市高三3月联考理科综合试卷(化学部分) 题型:填空题
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
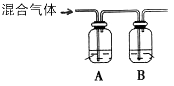
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应放出或吸收的能量 | x kJ | y kJ | z kJ | |
| 反应物转化率 | Ф1 | Ф2 | Ф3 | |
查看答案和解析>>
科目: 来源:2011-2012学年浙江省永嘉县普高联合体高二第二学期第一次月考化学试卷 题型:填空题
(4分)某温度时,2L容器中X、Y、Z三种物质的量随时间的变化如图所示。由图中数据分析,该反应的化学方程式为__ ;反应开始至2min ,Z的平均反应速率为 。
查看答案和解析>>
科目: 来源:2012届山东省诸城繁华中学高三下学期假期学习效果检测考试化学试卷 题型:填空题
(9分)(1)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率
v (H2)=________________
②分析右图所示图像,下列说法正确的是_________(填序号)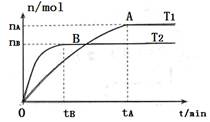
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(2) 加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(3) 在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
查看答案和解析>>
科目: 来源:2011-2012学年广东省汕头金山中学高一第一学期期末考试化学(理)试卷 题型:填空题
(7分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0试回答下列问题:
CO2(g)+H2(g) △H<0试回答下列问题:
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= 。
(2)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2012届北京市石景山区高三上学期期末考试化学试卷 题型:填空题
. (10分)下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式 。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
________(填写字母序号)。
| A.缩小反应容器的容积 |
| B.扩大反应容器的容积 |
| C.升高温度 |
| D.使用合适的催化剂 |
查看答案和解析>>
科目: 来源:2012届黑龙江省牡丹江一中高三上学期期末考试化学试卷 题型:填空题
(10分)甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,
CO与H2反应可制得甲醇:CO+2H2  CH3OH
CH3OH
图1表示该反应进行过程中的能量变化:
图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,结合图1写出液态CH3OH燃烧热的热化学方程式 。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/LHCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH溶液中滴加NaOH溶液,当溶液中离子浓度关系满足:c(HCOO-)<c(Na+)时,则反应的情况可能为 。(填字母)
A.NaOH不足,HCOOH剩余
B.HCOOH与NaOH恰好完全反应
C.NaOH过量
查看答案和解析>>
科目: 来源:2011-2012学年云南蒙自高中高二上学期期中考试化学试卷 题型:填空题
(6分)某化学科研小组研究在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表示]化学平衡的影响,得到如图所示图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):
cC(g)表示]化学平衡的影响,得到如图所示图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率):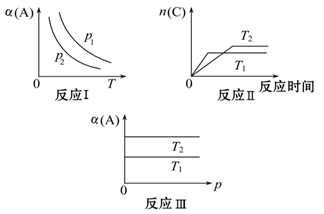
分析图像,回答下列问题:
(1)在图像反应Ⅰ中,若P1<P2(填“>”、“<”或“=”),则此正反应为是一个气体分子数_____(填“减少”或“增大”)的反应,该正反应为_____(填“吸热”或“放热”)反应。由此判断,此反应自发进行的温度是__ ___。(填“低温”“高温”“任何温度”)
(2)在图像反应Ⅱ中,T1_____T2(填“>”、“<”或“=”),该正反应为_____(填“吸热”或“放热”)反应。
(3)在图像反应Ⅲ中,若T1>T2,该反应能否自发进行
查看答案和解析>>
科目: 来源:2011-2012学年云南蒙自高中高二上学期期中考试化学试卷 题型:填空题
(6分)高炉炼铁过程中发生的主要反应为:
1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下: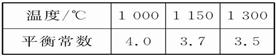
请回答下列问题:
(1)该反应的平衡常数表达式K=_____,ΔH____0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平衡反应速率v(CO2)=_____、CO的平衡转化率=_____;
查看答案和解析>>
科目: 来源:2011-2012学年云南蒙自高中高二上学期10月教学质量监测化学试卷 题型:填空题
(14分)(1)在一定温度下,将2molA和2molB两种气体混合于2L密闭容器中,发生反应:3A(g)+2B(g) x C(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断:
x C(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断: ① x值等于 ; ② B的平衡浓度为 。
① x值等于 ; ② B的平衡浓度为 。 ③ A的转化率为 。
③ A的转化率为 。
④由于条件改变而引起反应速率和化学平衡的变化情况,a---b过程中改变的条件可能是 ;b----c过程中改变的条件可能是 ;之后若增大压强时,请把反应速率变化情况画在上图中的c-----d处(标明V正和V逆)该条件下反应建立新平衡后体系中混合气体的平均相对分子质量 (填“增大”或“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2011-2012学年云南蒙自高中高二上学期10月教学质量监测化学试卷 题型:填空题
(5分)在密闭容器中进行的反应C(s)+ H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)  ,改变下列条件:(1)若升高温度,正反应速率 ,逆反应速率 (填增大或减小或不变),平衡 移动。
,改变下列条件:(1)若升高温度,正反应速率 ,逆反应速率 (填增大或减小或不变),平衡 移动。
(2)若增大CO的浓度,平衡 移动,H2O(g)的转化率 (填增大或减小或不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com