
科目: 来源:2011-2012学年广东省三校高二下学期联考化学试卷(带解析) 题型:填空题
(14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行( )次实验。
| A.1 | B.2 | C.3 | D.4 |
查看答案和解析>>
科目: 来源:2011-2012学年广东省三校高二下学期联考化学试卷(带解析) 题型:填空题
.(10分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理。
(1)在固定容积的密闭容器中,反应A(g)+2B(g) 4C(g),
4C(g), H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是 __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是 __
A.增加B的物质的量 B.加压 C.升温 D.使用催化剂
(2)某溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ____c(CH3COOH),混合后溶液中c(CH3COO-)____c(Na+)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒(不考虑Zn粒对反应速率的影响),反应过程中两溶液的pH变化如下图所示。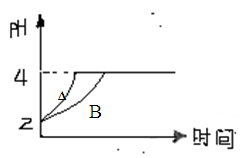
则图中表示醋酸溶液中pH变化曲线的是 (填A或B)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1 m2(选填<﹑=﹑>)
查看答案和解析>>
科目: 来源:2011-2012学年江西省白鹭洲中学高二下学期第三次月考化学试卷(带解析) 题型:填空题
(14分)I.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g)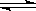 N2O4(g)△H<0。
N2O4(g)△H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率 。
II.已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平
衡后,c(P)="2" mol·L-1,a= mol·L-1。
查看答案和解析>>
科目: 来源:2011-2012年海南省海南中学高二下学期期中考试理科化学试卷(带解析) 题型:填空题
(16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)? ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
查看答案和解析>>
科目: 来源:2011-2012年江苏淮安市范集中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)已知化学反应①Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。查看答案和解析>>
科目: 来源:2011-2012年江苏淮安市范集中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(10分)可逆反应:mA(g)+nB(g)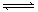 pC(g)+qD(g),根据图回答:
pC(g)+qD(g),根据图回答:
(1)压强P1比P2 (填大或小); (2)(m +m)比(p +q) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应(填吸热或放热);
(5)一定温度下,该可逆反应的平衡常数表达式为:K=
查看答案和解析>>
科目: 来源:2011-2012学年江西省高安中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0 B.DH>0,DS<0 C.DH<0,DS<0 D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率
v(CH3OH) = mol·(L·min)-1;
H2的转化率 =
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
查看答案和解析>>
科目: 来源:2011-2012学年江西省高安中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(8分)一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2? ?N2O4。反应中测得相关数据如下表所示:
?N2O4。反应中测得相关数据如下表所示:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |

查看答案和解析>>
科目: 来源:2011-2012学年江苏省扬州市邗江区高二下学期期中考试化学试卷(带解析) 题型:填空题
(14分)CO2可转化成有机物实现碳循环。
(1)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。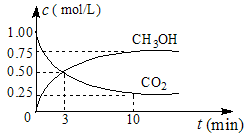
①从0 min到10 min,v(H2)= mol·(L·min)-1。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.将H2O(g)从体系中分离 B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1 mol CO2和3 mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实。
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在一定压强下,测得反应的实验数据如下表。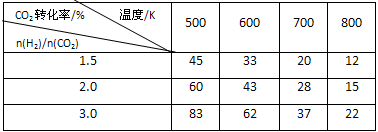
分析表中数据回答下列问题:
①反应的温度升高,K值 (填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”或“不变”)。
(3)800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)  CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。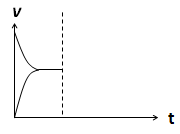
查看答案和解析>>
科目: 来源:2011-2012学年江苏省扬州市邗江区高二下学期期中考试化学试卷(带解析) 题型:填空题
(10分)在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)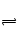 3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
请回答下列问题,
(1)该反应的焓变△H 0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω= ,A物质的转化率与B物质的转化率之比为 。
(3)30℃时,若在同一容器中加入1.5 mol A、 mol B和1.5 mol C,则平衡混合气中C的体积分数仍为ω,此时平衡体系中A的物质的量浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com