
科目: 来源:2012-2013学年山西省山大附中高一下学期期中考试化学试卷(带解析) 题型:填空题
在2 L的密闭容器中,放入0.4 mol A和0.6 mol B,在一定温度下,压强为p,放入催化剂(体积忽略),发生反应2A(g)+3B(g) xC(g)+2D(g),在a min后,容器中c(A)=0. 1 mol·L-1,则a min内,v(B)=______ ______;若温度不变,压强变为0.9p,则v(C)=____ ___,x=_________。
xC(g)+2D(g),在a min后,容器中c(A)=0. 1 mol·L-1,则a min内,v(B)=______ ______;若温度不变,压强变为0.9p,则v(C)=____ ___,x=_________。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省宿迁市泗洪县洪翔中学高二下学期期中考化学卷(带解析) 题型:填空题
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________ ,
K值的大小与温度的关系是:温度升高,K值__________ (填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)高炉炼铁中发生的基本反应之一为:CO(g) + FeO(s)  CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
①升高温度,平衡移动达到新的平衡时,高炉内CO 和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
②1100℃时测得高炉中c(CO )="0.025"
)="0.025"  ,
,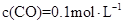 ,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度
,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度 (正)__________
(正)__________ (逆)(选填“>”、“<”或“:”),其原因是________________。
(逆)(选填“>”、“<”或“:”),其原因是________________。
查看答案和解析>>
科目: 来源:2012-2013学年辽宁省东北育才双语学校高一下学期期中考文科化学卷(带解析) 题型:填空题
已知NO2和N2O4可以相互转化: N2O4  2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
(1)前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s
(2)在4s时容器内的压强为开始时的 倍
(3)在平衡时容器内含N2O4 mol
(4)在平衡时容器内NO2的浓度为 mol/L
(5)平衡时N2O4的转化率为
查看答案和解析>>
科目: 来源:2012-2013学年江苏省淮安市楚州区范集中学高一下期期中考试化学卷(带解析) 题型:填空题
某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如右图所示。由图中数据分析,该反应的化学方程式为_______ _______________________。
反应开始至2min,Z的平均反应速率为____ ________________。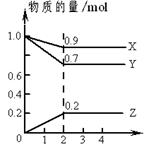
查看答案和解析>>
科目: 来源:2012-2013学年四川省雅安中学高二下学期期中考试化学试卷(带解析) 题型:填空题
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
查看答案和解析>>
科目: 来源:2013届新疆乌鲁木齐地区高三第一次诊断性测验化学试卷(带解析) 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: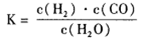
它所对应反应的化学方程式为_______。
已知在一定温度下,在同一平衡体系中各反应及平衡常数如下:
则K1、K2、K3之间的关系为_______。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:
该反应的逆反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为_______。
(3)甲醇是一种新型的汽车动力燃料,可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为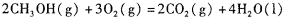 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。
(5) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
查看答案和解析>>
科目: 来源:2013届浙江省宁波一中2013届高三12月月考化学试卷(带解析) 题型:填空题
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。
若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2013届天津市十二校高三第二次模拟联考化学试卷(带解析) 题型:填空题
钛(Ti)被称为继铁、铝之后的第三金属,也有人说21世纪是钛的世纪。钛在地壳中的含量并不少,但钛的冶炼技术还未获得突破,目前钛只用于尖端领域。
如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可大大提高资源利用率,减少环境污染。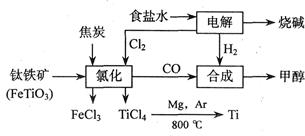
请填写下列空白:
(1)用惰性电极电解2 L食盐水时,总反应的离子方程式_______________________________,当阴极上产生224 mL气体(标准状况)时,所得溶液的pH= (假设电解前后溶液体积不变,食盐水足量)。
(2)写出高温下钛铁矿经氯化得到四氯化钛的化学方程式 。(提示:FeTiO3中Ti为+4价)
(3)反应2Mg+TiCl4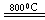 2MgCl4+Ti在Ar气氛中进行的理由是____________________。
2MgCl4+Ti在Ar气氛中进行的理由是____________________。
(4)二甲醚是一种重要的清洁燃料,可以通过甲醇分子间脱水制得:
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
CH3OCH3(g)+H2O(g) ΔH=" -23.5" kJ/mol
T1 ℃时,在恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如下图所示。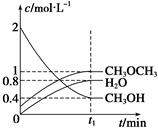
①T1 ℃时,该反应的平衡常数为 ;
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)="0.4" mol/L、c(H2O)="0.6" mol/L、(CH3OCH3)="1.2" mol/L,此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
(5)在上述产业链中,合成192吨甲醇理论上需额外补充H2__________吨 (不考虑生产过程中物质的任何损失)。
查看答案和解析>>
科目: 来源:2013届浙江省嘉兴市高三上学期基础测试化学试卷(带解析) 题型:填空题
已知: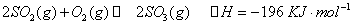 时,在2L固定容积的密闭容器中充入2mol
时,在2L固定容积的密闭容器中充入2mol 和2mol
和2mol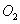 ,10分钟后达到平衡,
,10分钟后达到平衡, 浓度和时间关系如图。
浓度和时间关系如图。
回答下列问题
(1)前5分钟内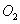 的平均反应速率为
的平均反应速率为
(2)能说明上述反应一定达到平衡的条件是
A.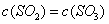 | B.气体总物质的量不变 |
C.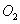 的浓度保持不变 的浓度保持不变 | D.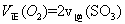 ) ) |
 ,请在图上画出15-25分钟
,请在图上画出15-25分钟 的浓度变化曲线。
的浓度变化曲线。查看答案和解析>>
科目: 来源:2012-2013学年浙江省嵊泗中学高二下学期第一次月考化学试卷(带解析) 题型:填空题
恒容容积为VL的密闭容器中发生2NO2 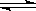 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。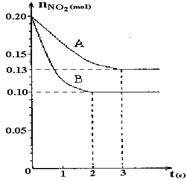
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是 。
A.有、无催化剂 B.温度不同
C.压强不同 D.体积不同
(2)写出该反应的化学平衡常数K的表达式: ,并比较K800℃ K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)= 。
(4)不能说明该反应已达到平衡状态的是 。
A.v正(NO2)=v逆(NO) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com