
科目: 来源:2011-2012学年天津市蓟县一中高二第三次月考化学试卷(带解析) 题型:单选题
下列对沉淀溶解平衡的描述正确的是
| A.电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程 |
| B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
| C.沉淀溶解达到平衡时,溶液中溶质的各离子浓度相等,且保持不变 |
| D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目: 来源:2011-2012天津南开中学高二第一学期期中考试理科化学试卷(带解析) 题型:单选题
高温下,某反应达平衡,平衡常数K= .恒容时,温度升高,H2浓度减小。下列说法正确的是
.恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
| D.该反应化学方程式为CO+H2O=CO2+H2 |
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联合体高二下学期期末考试化学试卷(带解析) 题型:单选题
25℃时,5种银盐的溶度积常数(Ksp)分别是:
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
查看答案和解析>>
科目: 来源:2011-2012学年浙江省宁波市八校高二下学期期末联考化学试卷(带解析) 题型:单选题
下列说法正确的是
| A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积一定是个常数 |
| B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2 |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入少量盐酸,Ksp值变大 |
查看答案和解析>>
科目: 来源:2012届山东省菏泽学院附中高三5月高考冲刺理科综合化学试卷(带解析) 题型:单选题
已知某温度下,Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(Ag2CrO4)=1×10-12 mol3·L-3,下列叙述正确的是
| A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C.向0.0008 mol·L- 1的K2CrO4溶液中加入等体积的0.002 mol/L AgNO3 溶液,则CrO42-完全沉淀 |
| D.将0.001 mol·L- 1的AgNO3 溶液滴入0.001 mol·L- 1的KCl和0.001 mol·L- 1的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
科目: 来源:2012届黑龙江省哈六中高三第三次模拟考试理综化学试卷(带解析) 题型:单选题
已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15,在AB2、AC均为饱和的混合液中,测得c(B-)=1.6×10-3 mol·L-1,则溶液中c(C2-)为 ( )
A.1.8×10-13 mol·L-1 B.7.3×10-13 mol·L-1
C.2.3 mol·L-1 D.3.7 mol·L-1
查看答案和解析>>
科目: 来源:2012届江苏省扬州中学高三下学期质量检测(三)化学试卷(带解析) 题型:单选题
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38[来源:学科网ZXXK] |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目: 来源:2011-2012学年四川省成都七中高二下学期期中考试化学试卷(带解析) 题型:单选题
常温下,对于醋酸溶液的下列说法中,不正确的是
| A.0.1 mol·L-1的醋酸溶液中加水稀释,溶液中c(OH-)减小 |
| B.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| C.pH=4的醋酸溶液与pH=10的烧碱溶液等体积混合后溶液呈酸性 |
| D.醋酸溶液中加入少量醋酸钾晶体,醋酸电离程度减小 |
查看答案和解析>>
科目: 来源:2011-2012学年四川省成都七中高二下学期期中考试化学试卷(带解析) 题型:单选题
25℃时,水的电离达到平衡:H2O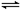 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
| A.向水中加入稀醋酸,平衡逆移,c(H+)降低 |
| B.将水加热,KW增大,pH不变 |
| C.向水中加入少量固体硫酸氢钾,c(H+)增大,KW不变 |
| D.pH=10的NaOH溶液与pH=10的NaClO溶液中,水电离c(H+)之比等于106 |
查看答案和解析>>
科目: 来源:2012届浙江省绍兴一中高三5月模拟考试理科综合化学试卷(带解析) 题型:单选题
定量分析中可用AgNO3溶液滴定Cl-溶液,加入K2CrO4为指示剂,达到滴定终点时溶液体积为50mL,c(Cl-) = 10-5 mol·L-1,AgNO3与CrO42- 生成砖红色的Ag2CrO4沉淀。已知Ksp(AgCl) = 1.77×10-10,Ksp(AgI) = 8.51×10-17,Ksp(Ag2CrO4) = 1.12×10-12,根据以上实验操作和有关数据,下列说法正确的是
| A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变 |
| B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1 |
| C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl) |
| D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com