
科目: 来源:2010—2011学年浙江省杭州十四中高二下学期期中考试化学试卷 题型:填空题
(12分)双氧水(H2O2)和水都是极弱的电解质。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式 。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐,请写出H2O2与Ba(OH)2作用形成正盐的化学方程式: 。
(3)水电离生成H3O+和OH-叫做水的自偶电离。双氧水同水一样,也有极微弱的自偶电离,其自偶电离的方程式为 。
(4)除了过氧化氢跟碱的反应外,请你再写出一个可表明双氧水是弱酸的反应的化学方程式 。
查看答案和解析>>
科目: 来源:2010—2011学年浙江省杭州十四中高二下学期期中考试化学试卷 题型:填空题
(8分)在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
(1)加水前导电能力为零的理由是:
(2)a、b、c、d四点醋酸的电离度大小顺序是
(3)a、b、c、d四点溶液PH值大小顺序是
(4)若要把b点溶液中(CH3COO-)、(OH-)均减小,可采用的方法是 (选择正确的选项)
| A.加水 | B.加NaOH | C.加H2SO4 | D.加Na2CO3 |
查看答案和解析>>
科目: 来源:2010—2011学年浙江省杭州十四中高二下学期期中考试化学试卷 题型:填空题
(4分)已知HCO3—比HBrO更难电离,但HBrO的酸性比H2CO3弱,写出以下反应的离子方程式:
(1)向NaHCO3溶液中滴加少量溴水:
(2)向Na2CO3溶液中滴加少量溴水:
查看答案和解析>>
科目: 来源:2010—2011学年浙江省杭州学军中学高二下学期期中考试化学试卷 题型:填空题
(10分)
Ⅰ、A物质的化学式为M(OH)2,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2+ + 2OH-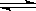 M(OH)2
M(OH)2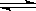 2H+ + MO22-
2H+ + MO22-
回答以下题目一律用“增大”“减小”“不变”填空
(1)在其他条件不变的情况下,25Co时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-) ,C(H+) ,水的电离度 ,Kw
(2)(4分)25Co时,向A的稀溶液中加入少量的烧碱固体。
则水的电离度 ,溶液的pH
Ⅱ、.(2分)室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为 10 (填大于、等于或小于)
查看答案和解析>>
科目: 来源:2010—2011届浙江省杭州市西湖高级中学高二4月月考化学试卷 题型:填空题
(2分).已知常温下0.4mol/L的某酸的pH值为3,则由水电离出的OH-浓度为 ,该酸的电离度为: 。
查看答案和解析>>
科目: 来源:2011届浙江省杭州市长河高中高三市二测模考(理综)化学部分 题型:填空题
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A.c(H+) | B.c(H+)/ c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/ c(H+) |

查看答案和解析>>
科目: 来源:2011届吉林省长春市高三第二次模拟考试(理综)化学部分 题型:填空题
(14分).A、B、C、 D、 E五种溶液分别是NaOH、 NH3·H2O、 CH3COOH 、HCl 、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充
分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2) 用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)
① ; ②
; ② 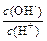 ;
;
③c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A="E " ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如下图中的_________曲线(填写序号) 。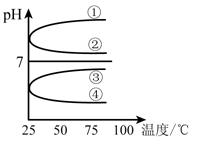
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
查看答案和解析>>
科目: 来源:2010—2011年福建安溪一中、惠安一中、养正中学高二上学期期末联考化学卷 题型:填空题
(16分)
(1)已知298K时,Fe(OH)3的溶度积常数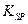 =2.6×10-39,Mg(OH)2的溶度积常数
=2.6×10-39,Mg(OH)2的溶度积常数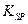 =5.6×
=5.6× ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
有没有Mg(OH)2沉淀生成______________填“有”或“无”),理由是________________________________。
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ .过程③的转化需要在HCl气流中加热,HCl的作用是
.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
查看答案和解析>>
科目: 来源:2010—2011学年湖北省黄冈中学高二上学期期末考试化学试卷 题型:填空题
(7分)已知硫酸在水中的电离方程式是:H2SO4 ═ H+ + HSO 4— ; HSO4—
4— ; HSO4— H++SO42—,回答下列问题:
H++SO42—,回答下列问题:
(1)Na2SO4溶液显 (填“酸性”,“中性”或“碱性”)。理由是(用离子 方程式表示) 。
方程式表示) 。
(2)在0.1 mol·L-1的Na2SO4溶液中,下列微粒浓度关系正确的有 。
A.c  (SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 (SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 |
| B.c(OH-)=c(H+)+c(HSO4—) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)=2c(SO42—)+2c(HSO4—) |
查看答案和解析>>
科目: 来源:2010—2011学年广东省梅州市曾宪梓中学高二上学期期末考试理综)化学部分 题型:填空题
(16分)
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com