
科目: 来源:2011-2012学年辽宁省沈阳四校协作体高二上学期期中考试化学试卷 题型:填空题
(16分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA-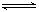 H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 。
(2)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母)。
| A.c(Na+)+c(K+)=c(HA-)+c(A2-) | B.水的离子积KW=c 2(OH-) 2(OH-) |
| C.V=10 | D.c(K+)<c(Na+) |
 已知难溶物CaA在水中存在溶解平衡;CaA(s)
已知难溶物CaA在水中存在溶解平衡;CaA(s) 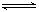 Ca2++A2-;ΔH>0。
Ca2++A2-;ΔH>0。查看答案和解析>>
科目: 来源:2012届河北省南宫中学高三上学期期中考试化学试卷 题型:填空题
(12分)在常温下,下列三种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是:
(用离子方程式表示)
(2)在上述三种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源:2011-2012学年黑龙江省大庆实验中学高二上学期期中考试化学试卷 题型:填空题
化合物SOCl2是一种液态化合物,沸点为77℃。在盛10ml水的锥形瓶中小心滴加8-10滴SOCl2可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出,该气体可使湿润的品红试纸褪色。在反应后的溶液中滴加AgNO3溶液,可生成一种不溶于稀HNO3的白色沉淀。
(1)试据上述实验事实,写出SOCl2与水反应的化学方程式 。
(2)将ZnCl2溶液蒸发至干,得不到无水ZnCl2,工业上常用ZnCl2?2H2O与SOCl2共热制取ZnCl2。试结合离子方程式解释原因: 。
(3)科学家经常利用 水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式: 。
水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式: 。
查看答案和解析>>
科目: 来源:2011-2012学年山西省大同市实验中学高二上学期期中考试化学试卷 题型:填空题
在室温下,下列五种溶液①0.1mol/LNH4Cl ②0.1mol/LCH3COONH4 ③ 0.1mol/ L NH4HSO4 ④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液 ⑤0.1mol/LNH
0.1mol/ L NH4HSO4 ④0.1mol/LNH3·H2O和0.1mol/LNH4Cl的混合溶液 ⑤0.1mol/LNH 3·H2O
3·H2O
(1)溶液①呈___性(填“酸”“碱”或“中”)其原因是____________________________(用离子方程式表示)
(2 )比较溶液②、③中C(NH4+)的大小关系是____________________(填>,<或=)
)比较溶液②、③中C(NH4+)的大小关系是____________________(填>,<或=)
(3)在溶液④中,_____________离子的浓度为0.1mol/L
NH3·H2O和_________离子的物质的量浓度之和为0.2mol/L
(4) 室温下测得溶液②的PH=7,则说明CH3COO-的水解程度_______(填>,<或=")" NH4+的水解程度,C(CH3COO-)_________C(NH4+)(填>,<或=)
查看答案和解析>>
科目: 来源:2011—2012学年黑龙江哈九中度高二上学期期中考试化学试卷 题型:填空题
(7分)
(1)在0.1mol/L的NH4Cl溶液中,各离子浓度由大到小的顺序是
(2)电解质溶液中存在着多种平衡,现有室温下0.1mol/L的NaHCO3溶液,pH=8,回答问题:
①写出溶液中存在的多种平衡(用离子方程式表示)
②下面关系式正确的是________
| A.c(Na+) + c(H+) = c(CO32-) + c(HCO3-) + c(OH-) |
| B.c(Na+) > c(HCO3-) > c(OH-) > c(H2CO3) > c(H+) |
| C.c(OH—) = c(H+) + c(H2CO3) — c(CO32-) |
| D.c(Na+) = c(HCO3-) + c(H2CO3) |
查看答案和解析>>
科目: 来源:2011—2012学年黑龙江哈九中度高二上学期期中考试化学试卷 题型:填空题
(10分)(1)写出稀硫酸与硫代硫酸钠溶液混合的离子方程式
(2)向FeCl3稀溶液中滴加少量KSCN稀溶液,离子方程式为
(2)若再向其中滴加少量硫氰化铵或硫酸铁浓溶液,现象是
(3)实验室配制FeCl3溶液的方法是:
(4)滴有酚酞试液的Na2CO3溶液显_______色,若给溶液加热,溶液颜色会_________,其原因是_____________________________________________(用方程式结合必要的文字回答)
查看答案和解析>>
科目: 来源:2011-2012年黑龙江省鹤岗一中高二上学期期中考试化学试卷 题型:填空题
(8分)⑴浓度均为0.1mol/L的8种溶液:① HNO3 ② H2SO4 ③ CH3COOH ④ Ba(OH)2 ⑤NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液pH值由小到大的顺序是(填写编号) ________________。
(2)氯化铝水溶液呈 性,原 因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
查看答案和解析>>
科目: 来源:2011-2012年黑龙江省鹤岗一中高二上学期期中考试化学试卷 题型:填空题
(6分)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸__(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式__________。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈____(填“酸性” 、 “中性” 或 “碱性”),其原因是(用离子方程式表示)__________。
“中性” 或 “碱性”),其原因是(用离子方程式表示)__________。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
查看答案和解析>>
科目: 来源:2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷 题型:填空题
(12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度 (mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
 c(Na+)离子浓度的大小关系是 (填序号)。A.前者大 B.后者大 C.一样大 D.无法判断
c(Na+)离子浓度的大小关系是 (填序号)。A.前者大 B.后者大 C.一样大 D.无法判断查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com