
科目: 来源:2012-2013学年江苏省涟水中学高二5月学分认定模块检测化学试卷(带解析) 题型:填空题
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |

查看答案和解析>>
科目: 来源:2012-2013学年云南省昆明三中、滇池中学高二下学期期末考试化学卷(带解析) 题型:填空题
(1)已知:25℃时,一些弱电解质的电离常数如下:NH3·H2O:1.77×10—5 H2CO3:4.3×10—7(第一步电离)。则:NH4HCO3溶液显 性 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,醋酸体积 (填“>”、“<”、“=”)氢氧化钠溶液体积。
(3)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=10,A溶液呈碱性的原因是(用离子方式程式表示)________________
(4)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是: ;有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请您运用所学知识解释
(5)已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10—15。在AB2、AC均为饱和的混合液中,测得c(B—)=1.6×10—3 mol·L-1,则溶液中c(C2—)为 mol/L。
查看答案和解析>>
科目: 来源:2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(带解析) 题型:填空题
写出NaHCO3在水溶液中所发生的电离与水解反应的离子方程式,
并写出溶液中的电荷守恒的表达式
溶液中的物料守恒(即原子守恒)的表达式
查看答案和解析>>
科目: 来源:2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(带解析) 题型:填空题
常温下,如果取0.1mol·L-1HA溶液与0.1mol···L-1NaOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=8,请回答下列问题:
(1)混合后溶液的pH=8的原因(用离子方程式表示): 。
(2)混合溶液中由水电离出的c(H+) (填<、>、=)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Na+) -c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2CO3 D.NH4Cl
按pH由大到小的顺序排列: (填序号)。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省东台市唐洋中学高二下学期期中考试化学试卷(带解析) 题型:填空题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度 (mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目: 来源:2013届河北省大城县第一中学高三3月月考化学试卷(带解析) 题型:填空题
A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)相同温度下,当A1、B1的物质的量浓度相等时,两种溶液中水电离出的氢离子的物质的量浓度之比为________。
(3)0.1mol?L-1NaNO2溶液中离子浓度由大到小的顺序为___________________________________。
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是___________。
(5)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
查看答案和解析>>
科目: 来源:2013届海南省琼海市嘉积中学高三下学期第一次月考化学试卷(带解析) 题型:填空题
(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2= (溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH 7
②若溶液pH<7,则c(Na+) c(A-)
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则
下列说法正确的是 (填选项代号).
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
查看答案和解析>>
科目: 来源:2013届湖南省怀化市高三上学期期末考试化学试卷(带解析) 题型:填空题
现有下列10种物质:
①NaHCO3;②NH4HCO3;③BaSO4;④HF;⑤C2H5OH;⑥Al;⑦食盐水;⑧CH3COOH; ⑨HCl; ⑩NaOH。
(1)其中属于非电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟NaOH溶液反应的是_____________。
(2)NaHCO3溶液显 性(填“酸”、“碱”或“中”),原因是(结合离子方程式表示)
。
(3)常温时有四种溶液:Ⅰ.pH=4的CH3COOH溶液;Ⅱ.pH=4的HCl溶液;Ⅲ.pH=10的NaOH溶液;Ⅳ.pH=10的CH3COONa溶液。(已知常温时醋酸的电离常数为1.75×10-5)
下列有关叙述正确的是 。(忽略溶液混合时的体积变化)
| A.Ⅱ、Ⅲ溶液分别与10g铝粉充分反应,生成H2的量Ⅲ一定更多 |
| B.Ⅰ与Ⅱ等体积混合后,溶液中的c(CH3COO-)为原溶液浓度的1/2 |
| C.将Ⅰ和Ⅲ等体积混合后,溶液pH一定小于7 |
| D.四种溶液各10mL分别加水稀释至100mL后,溶液的pH:Ⅲ>Ⅳ>Ⅰ>Ⅱ |
查看答案和解析>>
科目: 来源:2010年浙江省浙东北三校高二第二学期期中联考化学试题 题型:填空题
(共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示): ; ;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S) 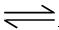 Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1
查看答案和解析>>
科目: 来源:2012-2013学年湖北荆门高二上学期期末教学质量检测化学试卷(带解析) 题型:填空题
(1)向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到白色沉淀转变为红褐色沉淀。简述产生该现象的原因: 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字): c(OH-)-c(HA)= mol/L。
(4)已知25℃时,AgCl的溶解度为1.435×10-4g,则该温度下AgCl的溶度积常数
Ksp= mol2/L2。
电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com