
科目: 来源:2010年山西省山大附中高二12月月考化学试卷 题型:填空题
(1)Mg(OH)2在下列四种情况下,其溶解度大小关系为_______________。
A.在纯水中 B.在0.1 mol ·L-1的MgCl2溶液中 C.在0.1 mol ·L-1的CH3COOH溶液中
(2)向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
查看答案和解析>>
科目: 来源:2011届福建省三明一中高三上学期第三次月考化学试卷 题型:填空题
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
查看答案和解析>>
科目: 来源:2010年江西省德兴市四校联考高二上学期期中考试化学试卷 题型:填空题
设反应①Fe(S)+CO2(g) FeO(S)+CO(g)的平衡常数为
FeO(S)+CO(g)的平衡常数为 。反应②Fe(S)+H2O(g)
。反应②Fe(S)+H2O(g) FeO(S)+H2(g)的平衡常数为
FeO(S)+H2(g)的平衡常数为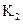 ,在不同温度下,
,在不同温度下, 、
、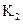 的值如下:
的值如下:
| 温度 | 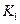 | 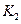 |
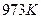 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
 H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K
H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K =____________。
=____________。 、K
、K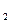 与K
与K 之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。
之间的关系式_______________。据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_____________(填写序号)。| A.缩小反应容器容积 | B.扩大反应容器容积 | C.降低温度 |
| D.升高温度 E.使用合适的催化剂 F.设法减少CO的量 |
 达到平衡、在时刻t
达到平衡、在时刻t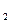 分别因改变某个条件而发生变化的情况:
分别因改变某个条件而发生变化的情况:
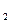 发生改变的条件是_____________________________
发生改变的条件是_____________________________ 发生改变的条件是________________
发生改变的条件是________________查看答案和解析>>
科目: 来源:2010年江西省德兴市四校联考高二上学期期中考试化学试卷 题型:填空题
在6份0.01mol/L氨水中分别加入下列各物质:
| A.浓氨水 | B.纯水 | C.少量浓H2SO4 | D.少量NaOH固体 E.少量Al2(SO4)3固体 |
查看答案和解析>>
科目: 来源:2010年江西省新余一中 宜春中学 高安中学高二上学期第三次段考化学试卷 题型:填空题
下表是不同温度下水的离子积的数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目: 来源:2010年北京五中高二下学期期末考试化学试题 题型:填空题
(7分)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw= 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH== 。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因 。
查看答案和解析>>
科目: 来源:2010年上海市闵行区高一第二学期质量调研考试化学试卷 题型:填空题
复分解反应的条件是生成_____________、_____________或____________。
查看答案和解析>>
科目: 来源:2010年福建省厦门市高二下学期质量检测化学试题 题型:填空题
(4分)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32一(aq) BaCO
BaCO 3(s)+SO42-(aq)(平衡常数K=0.042)
3(s)+SO42-(aq)(平衡常数K=0.042)
(1)现有0.20 mol BaSO4,每次用1.00 L 2.0 mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理 次。
(2)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是 。
查看答案和解析>>
科目: 来源:09~10年江西四校高二下学期期中联考化学卷 题型:填空题
(4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式: ▲ 。
(2)白色固体转化成黑色固体的原因是: ▲ 。
查看答案和解析>>
科目: 来源:2010年广州市执信中学高二第二学期期末考试化学试题 题型:填空题
根据以下信息回答下列问题。
Ⅰ .盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
.盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
Ⅱ.长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用盐酸除去。
①请用离子方程式表示盐碱地产生碱性的原因: ;
②请用化学方程式表示 加入石膏降低土壤碱性的反应原理 ;
加入石膏降低土壤碱性的反应原理 ;
③请写出水垢悬浊液中CaSO4溶解平衡的离子方程式 ;
④ 请分析水垢中的CaSO4转化为CaCO3的原理 ;
请分析水垢中的CaSO4转化为CaCO3的原理 ;
⑤请写出CaCO3溶于过量盐酸的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com