
科目: 来源:2012届新疆兵团二中高三第一次月考化学试卷 题型:填空题
(4分)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.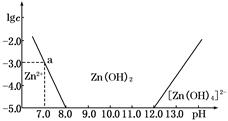
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
| c(HCl) | | | | | | | |
| (mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| 103c(PbCl2) | | | | | | | |
| (mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
| A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
| B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
| C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
| D.PbCl2固体可溶于饱和食盐水 |
查看答案和解析>>
科目: 来源:2010—2011学年浙江省温州市十校联合高二下学期期末联考化学试卷 题型:填空题
(6分)25℃时,KSP[Mg(OH)2]=5.6×10-12, KSP[MgF2]=7.42×10-11,在该温度下进行下列实验,回答相关问题:
(1)在同浓度的含OH-和F-的溶液中,逐滴加MgCl2溶液时,最先产生的沉淀是____①____
(2)Mg(OH)2可溶液于浓NH4Cl溶液,试解释产生该现象的原因___②___(用离子方程式表示)
(3)有人认为“难溶盐不能和碱溶液发生复分解反应”。若在MgF2悬浊液中滴加NaOH溶液,能否发生化学反应?若你认为能反应的,请写出该反应的离子方程式;若你认为不能反应的请说明理由。____③____
查看答案和解析>>
科目: 来源:2011届广东省六校高三下学期第三次模拟考试(理综)化学部分 题型:填空题
(16分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_____。
4Fe(OH)3+8OH-+_____。
K2FeO4在处理水的过程中所起的作用是 和 。
(2)常温下,Fe(OH)3 的Ksp = 4.0×10-38,请写出Fe(OH)3在水中的溶解平衡方程式
(3)将适量K2FeO4配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是 ;发生反应的△H 0(填“>”、“<”或“=”)。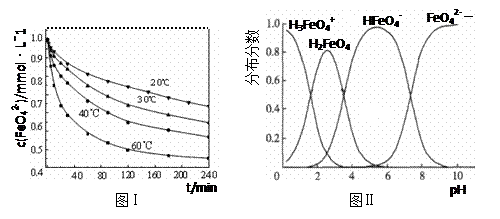
(4)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O
查看答案和解析>>
科目: 来源:2011届江西省临川二中高三下学期第一次模拟考试(理综)化学部分 题型:填空题
对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反 应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=
②科学研究发 现纳米级的Cu2O可作为太阳光分解水的催化剂。
现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下 ,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应: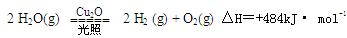 2 H2O(g)
2 H2O(g)
2 H2(g) + O2(g)△H=+484kJ· mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目: 来源:2010-2011学年新疆农七师高级中学高二下学期第一阶段考试化学试卷 题型:填空题
(10分)如表是不同温度下水的离子积数据:试回答以下问题:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
科目: 来源:2010-2011学年福建省莆田一中高二下学期第一学段考试化学试卷 题型:填空题
(6分)氢氧化铜悬浊液中存在如下平衡:
Cu(OH)2(s)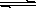 Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于 。
(2)除去CuCl2溶液中少量的Fe2+,可以按照下面的流程进行:
已知Fe2+、Cu2+、Fe3+ 三种离子开始沉淀和完全沉淀时溶液pH值如下:
| 金属 离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
 A.H2O2 B.KMnO4 C.HNO3 D.Cl2
A.H2O2 B.KMnO4 C.HNO3 D.Cl2查看答案和解析>>
科目: 来源:2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷 题型:填空题
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)== 1.8×10-10,Ksp(AgY)== 1.0×10-12,Ksp(AgZ)== 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(以被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为: _______________
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(填“增大”、“减小”或“不变”)。
(3)由上述Ksp判断,在上述(2)的体系中,能否实现AgY向AgZ的转化,并简述理由: _______
查看答案和解析>>
科目: 来源:2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷 题型:填空题
(10分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质, 控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见图。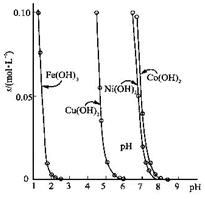
(1)pH=3时溶液中铜元素的主要存在形式是: (写化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为 (填字母)
A、<1 B、4左右 C、>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质, (能、不能)通过调节溶液pH的方法来除去,理由是
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以 加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
(5)已知一些难溶物的溶度积常数如下表。w.w.w.k.s.5.u.c.o.m
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |

查看答案和解析>>
科目: 来源:2011届福建省龙岩市高三上学期期末化学卷 题型:填空题
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
| A.氢氧化钠 | B.氧化铝 | C.氨水 | D.水 |
查看答案和解析>>
科目: 来源:2011届浙江省嵊州二中高三12月月考化学试卷 题型:填空题
(1) t℃时Na2SO4的溶解度是S g,其饱和溶液密度d g·cm-3,物质的量浓度为c mol·L-1。向足量饱和溶液中,加入X g无水Na2SO4或蒸发Yg水后恢复t℃,均能获得W g芒硝晶体,下列关系式正确的是 ▲
A. | B.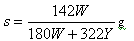 |
| C.100X=YS | D.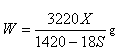 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com