
科目: 来源:2010年黑龙江省拜泉一中高二上学期期末考试化学试卷 题型:计算题
(8分)已知水在25℃和95℃时,其电离平衡曲线如下图所示: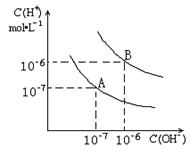
(1)25 时水的电离平衡曲线应为哪一条?
(2)25时,将=9的NaOH溶液与=4的溶液混合,若所得混合溶液的=7,则NaOH溶液与溶 液的体积比为为多少?
液的体积比为为多少?
(3)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是?
查看答案和解析>>
科目: 来源:2010年江西省新余九中高二上学期期中考试化学试卷 题型:计算题
已知t℃时,纯水中[H+]=2×10-7 mol·L-1,在该温度下Mg(OH)2的溶度积Ksp[Mg(OH)2]=3.2×10-11mol3·L-3,求该温度下饱和的Mg(OH)2溶液的pH为多少?
查看答案和解析>>
科目: 来源:2010年山西省临汾一中高二上学期期中考试化学试题 题型:计算题
(8分)1.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b="13" :(1)该温度下水的离子积常数K w的数值为 。
(2)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。(写出计算过程)
(3)常温下pH=5的H2SO4的溶液稀释500倍后,溶液中SO42-的浓度与H+浓度的比值约为 (写出计算过程)
查看答案和解析>>
科目: 来源:09—10年台州市高二下学期期末考试化学卷 题型:计算题
某温度下,纯水中c(H+)=1.0×10-6 mol·L-1,则此时c(OH-)= ▲ mol·L-1。
在此温度下,将100 mL pH=1的稀硫酸和盐酸的混合液与100 mL未知浓度的Ba (OH)2溶液相混合,充分反应后过滤,得0.233g沉淀,滤液的pH值变为11(设混合液体积为两者之和,所得固体体积忽略不计)。
则原混合酸液中SO42-的物质的量= ▲ mol。
Cl-的物质的量= ▲ mol。
Ba(OH)2的物质的量浓度= ▲ mol·L-1 。
查看答案和解析>>
科目: 来源:09~10学年浙江舟山七校高二下学期期末考试化学试题 题型:计算题
(6分)
一定温度下,测得某纯水的pH为6.5。试计算:
(1)此时水的离子积常数Kw为多少?
(2)若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1。的Ba(OH)2溶液,保持原温度,其溶液的pH为多少?
(3)取上述Ba(OH)2溶液200mL,加入含0.01mol 的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
查看答案和解析>>
科目: 来源:2009-2010学年(下)农七师高级中学高二(理)第二阶段化学试卷 题型:计算题
将5.13g Ba(OH)2粉末加入100 ml硫酸和盐酸的混合液中,充分反应至沉淀不再生成时,过滤得干燥沉淀5.825g。取滤液20ml跟足量铁粉反应,生成22.4ml(标准状况下)气体。求:
⑴滤液的pH
⑵原混合液中c(Clˉ)、c(SO42ˉ)。
查看答案和解析>>
科目: 来源:2010年浙江省温州二中高二第二学期期中考试化学试题 题型:计算题
某温度下的溶液中c (H+)=1.0×10x mol/L,c (OH-)=1.0×10y mol/L。x与y的关系如右图所示:
(1)求该温度下,中性溶液的pH;
(2)求该温度下0.01mol/LNaOH溶液的PH;
(3)该温度下,pH=a的醋酸溶液与pH=b的NaOH溶液等体积混合,恰好完全反应,求此醋酸溶液中醋酸的电离度。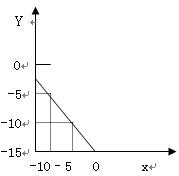
查看答案和解析>>
科目: 来源:江苏省普通高中化学学业水平测试卷 题型:计算题
(5分)将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是多少?
查看答案和解析>>
科目: 来源:2012-2013学年山东省聊城市某重点中学高一第四次模块检测化学试卷(带解析) 题型:计算题
某盐酸的密度为1.095g·cm-3,质量分数为10.0%,试计算:
(1)该盐酸的物质的量浓度是多少?
(2)200mL该盐酸跟足量的锌粒充分反应,生成气体的体积(标准状况下)是多少L?
查看答案和解析>>
科目: 来源:2012-2013学年河北枣强县中学高一上学期期末考试化学试卷(带解析) 题型:计算题
Ⅰ:(4分)若取4.00mol/L的氨水30.0mL与70.0mL2.00mol·L-1的AlCl3溶液相混合,产生白色沉淀的质量是 g
Ⅱ:(6分)实验室用4.35gMn02与l00 mL11mol/L的浓盐酸(足量)反应制取氯气。 试计算:
(1)在标准状况下,生成氯气的体积。(不考虑氯气在溶液中的溶解)
(2)将反应后的溶液加水稀释到500mL,向从其中取出的50mL溶液中加入足量AgN03溶液,生成沉淀的物质的量。(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com