
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
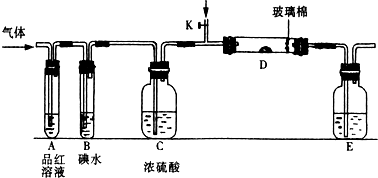
查看答案和解析>>
科目: 来源: 题型:单选题
 的数目为1.5NA
的数目为1.5NA查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
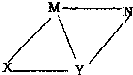 现有HCl,Ba(OH)2,Na2CO3,NaHCO3四种物质的澄清溶液,它们之间有如图所示的反应关系,图中每条线两端的物质均可相互反应,下列推断正确的是
现有HCl,Ba(OH)2,Na2CO3,NaHCO3四种物质的澄清溶液,它们之间有如图所示的反应关系,图中每条线两端的物质均可相互反应,下列推断正确的是查看答案和解析>>
科目: 来源: 题型:解答题
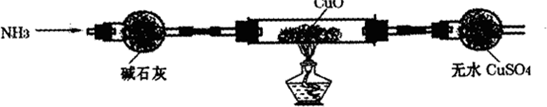
| 钠块质量 | 实验现象 |
| 0.2g | 钠块剧烈燃烧,发出爆炸声,少量的钠溅出 |
| 0.1g | 钠块燃烧,发出爆炸声 |
| 0.05g | 钠块四处游动,偶有轻微的爆炸声,未见钠块燃烧 |
查看答案和解析>>
科目: 来源: 题型:解答题
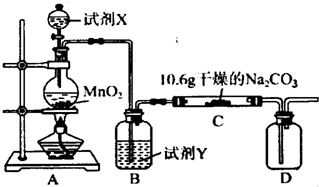
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |  |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.______ |
| 步骤3:______ | b.______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com