
科目: 来源:2013届山东省青岛二中高三上学期9月阶段性检测化学试卷(带解析) 题型:填空题
(10分)工业上处理含Cr2O72—的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.试回答:
(1)电解时的电极反应:阳极________________,阴极__________________________.
(2)Cr2O72—转变成Cr3+的离子反应方程式:_____________________.
(3)电解过程Cr(OH)3、Fe(OH)3沉淀是怎么产生的?
______________________________________.
(4)能否用Cu电极来代替Fe电极?________(填“能”或“不能”),简述理由______________________.
查看答案和解析>>
科目: 来源:2013届浙江省台州中学高三第一次统练化学试卷(带解析) 题型:填空题
(10分)地球的海水总量约有1.4×1018t,是人类最大的资源库。
(1)如图利用海水得到淡水的方法为 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图。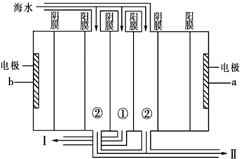
a是电源的 极;Ⅰ口排出的是 (填“淡水”或“浓水”)。
(3)海水淡化后的浓水中含大量盐分(主要含有Mg2+、Ca2+、Fe3+和SO42-),排入水中会改变水质,排到土壤中会导致土壤盐碱化,故不能直接排放,可以与氯碱工业联产。
电解前需要把浓水精制,所需试剂主要包括:HCl、NaOH、 BaCl2、Na2CO3等),其中HCl的作用主要是
(4)铀是核反应最重要的燃料,其提炼技术直接关系着一个国家核工业或核武器的发展水平,海水中铀以UCl4形式存在(以离子形式存在),每吨海水只含3.3毫克铀,海水总量极大,铀总量相当巨大。不少国家正在探索海水提铀的方法。现在,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的铀,而不吸附其他元素。其反应原理为:___________________________(树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为:________________________。
(5)离子交换树脂法是制备纯水(去离子水)的主要方法。某阳离子交换树酯的局部结构可写成(右图)。该阳离子交换树脂是由单体苯乙烯和交联剂对二乙烯基苯聚合后再经__ 反应得到的。自来水与该离子交换树脂交换作用后显 (填“酸性”、“碱性”或“中性”)。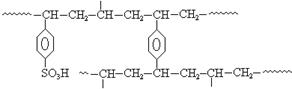
(6)中国《生活用水卫生标准》中规定,水的总硬度不能过大。如果硬度过大,饮用后对人体健康与日常生活有一定影响。暂时硬水的硬度是由 (填阴离子符号)引起的,经 (填操作名称)后可被去掉。永久硬水的硬度可由离子交换法去掉。
查看答案和解析>>
科目: 来源:2011-2012学年云南省昆明三中高二下学期期末考试化学试卷(带解析) 题型:填空题
(14分)某课外活动小组同学用图一装置进行实验,试回答下列问题。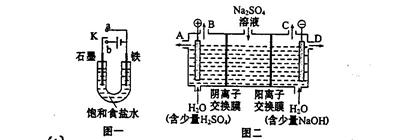
(1)① 若开始时开关K与a连接,则铁发生的是电化学腐蚀中的 腐蚀;
② 若开始时开关K与b连接,则总反应的离子方程式 。
(2)芒硝(化学式为Na2SO4·10H2O),无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法。用如图二所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率来看都更加符合绿色化学理念。
① 该电解槽的阳极反应式为: ,此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
② 制得的氢氧化钠溶液从出口(选填“A”、“B”、“C”、“D”) 导出。
③ 若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为 。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有 kJ的能量转化为电能。
查看答案和解析>>
科目: 来源:2012-2013学年安徽省舒城晓天中学高二上学期第二次月考化学试卷(带解析) 题型:填空题
将洁净的金属片A、B 、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如右表所示:

已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1) A、B、C、D四种金属中活泼性最强的是_____________(用字母表示)
(2)若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为___________(A、B、C、D中哪一种),此时对应的电极反应式为:正极___________________________________________
查看答案和解析>>
科目: 来源:2011-2012年湖北宜昌金东方学校高二上学期期末考试化学试卷(带解析) 题型:填空题
(9分)如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:
。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
查看答案和解析>>
科目: 来源:2013届广西桂林十八中高三上学期第一次月考化学试卷(带解析) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。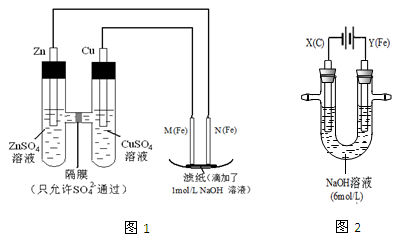
请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
| A.铝 | B.石墨 | C.银 | D.铂 |
查看答案和解析>>
科目: 来源:2011-2012学年河北省唐山一中高二第二次调研考试化学试卷(带解析) 题型:填空题
(9分)按要求对下图中两极进行必要的联接并填空:
(1)在A图中,使铜片上冒H2气泡。请加以必要联接,则联接后的装置叫 。电极反应式:
锌板: ;铜板: 。
(2)在B图中,a和 b都是石墨电极,使a极析出铜,则b析出: 。加以必要的联接后,电极反应式,a极: b极: 。经过一段时间后,停止反应后加入一定量的 ,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省舒城晓天中学高二下学期质量测试4化学试卷(带解析) 题型:填空题
(12分)(2009·山东理综)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是___ _____________________________________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn
c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省舒城晓天中学高二下学期质量测试4化学试卷(带解析) 题型:填空题
(12分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ ________________________________________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________
________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
查看答案和解析>>
科目: 来源:2011-2012学年安徽省六安三中高一下学期期末考试化学B卷(带解析) 题型:填空题
(10分)下列所示的装置中A为Zn,B为Cu,C、D均为碳棒。
则(1)A发生了____反应(填氧化或还原).C为____极。
(2)D极周围溶液中的现象____________________________________
原因是__________________________________________
(3)当A电极上的金属质量减少1.3g,则C电极上产生气体在标准状况下的体积为_________________________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com