
科目: 来源:2011年普通高等学校招生全国统一考试化学卷(北京) 题型:填空题
氯碱工业中电解饱和食盐水的原理示意图如右图所示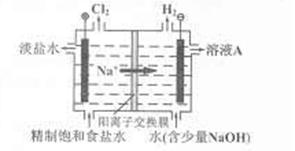
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
(4)电解所用的盐水需精制。去除有影响的 、
、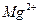 ,NH+3,
,NH+3,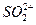 ,[
,[ >
>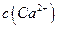 ]。
]。
精致流程如下(淡盐水和溶液A来电解池):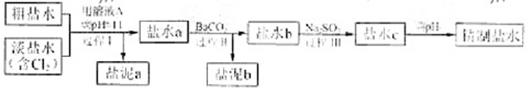
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③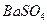 的溶解度比
的溶解度比 的小,过程Ⅱ中除去的离子有
的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水中c 中剩余 的含量小于5mg /l ,若盐水b中
的含量小于5mg /l ,若盐水b中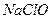 的含量是7.45 mg /l ,则处理10m3盐水b ,至多添加10%
的含量是7.45 mg /l ,则处理10m3盐水b ,至多添加10%  溶液 kg(溶液体积变化忽略不计)。
溶液 kg(溶液体积变化忽略不计)。
查看答案和解析>>
科目: 来源:2011届江西省赣县中学高三适应性考试(理科)化学部分 题型:填空题
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;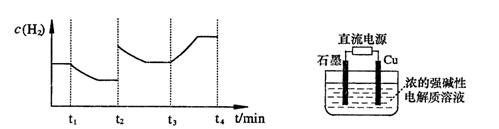
②一定 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
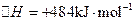 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
(2)已知: ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 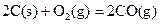 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式 ;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为 。
查看答案和解析>>
科目: 来源:2011届浙江省金华一中高三高考模拟考试(理综)化学部分 题型:填空题
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)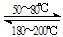 Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与▲ 极(填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。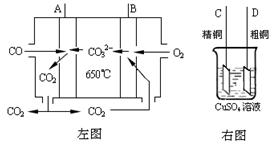
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+ Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42-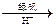 Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
查看答案和解析>>
科目: 来源:2011届江西省吉安一中高三模拟考试(理综)化学部分 题型:填空题
(15分)
工业上生产氯气,常在电解槽中电解饱和食盐水.
(1)写出该反应的离子方程式 ,电解槽中阳极材料应为 .为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图)为电解槽的示意图。
(2)这种阳离子交换膜,只允许溶液中的 通过;(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
写出在电解过程中发生的电极方程式:阳极: ;
(3)若不用阳离子交换膜,电解产物之间发生的主要反应方程式为 。
(4)已知某电解槽每小时加入10%的氢氧化钠溶液l0kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 ;
(5)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.
回答下列问题:
①写出在电解过程中发生的电极方程式:阴极: .
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
查看答案和解析>>
科目: 来源:2010-2011学年辽宁省师大附中高二下学期期中考试化学试卷 题型:填空题
(5分)在25℃时,用石墨电极电解2.0 L,2.5 mol/L CuSO4溶液,如有0.2 mol电子发生转移,试回答下列问题:
⑴电解后得到的Cu的质量是 ,得到O2的体积(标准状况)是 ,溶液的pH是 。
⑵如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的pH (填“变小”、“变大”或“不变”)
查看答案和解析>>
科目: 来源:2010-2011学年内蒙古赤峰二中高一下学期期中考试化学试卷 题型:填空题
(6分)按图所示装置,以石墨为电极电解氯化铜溶液。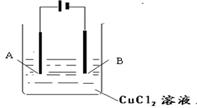
(1)阴极为 (“A”或“B”),阴极电极反应式
(2)如要用电解的方法精炼铜,电解液选用CuSO4溶液,则阳极的材料是 (填写“粗铜”或“纯铜”)
阳极电极反应式为(不写杂质 的) 。
的) 。
查看答案和解析>>
科目: 来源:2010-2011学年河南省驻马店市文成中学十校联合体高一下学期期中联考化学试卷 题型:填空题
(8分)按如图所示装置,用石墨电解氯化钠溶液,A极有无色无味气体放出,
(1) y是电源的 极。
(2)电极A的名称为 ,电极B的电极反应式为 .
检验该电极反应产物的方法是 。
(3)写出该电解反应的总化学方程式: 。
查看答案和解析>>
科目: 来源:2010—2011学年浙江省杭州十四中高二下学期期中考试化学试卷 题型:填空题
(10分)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题:
(1)电源A极的名称是 。
(2)甲装置中电解反应的总化学方程式是______________________ ___。
(3)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。
查看答案和解析>>
科目: 来源:2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷 题型:填空题
氢氧化钾是重要的工业产品。工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如
图所示。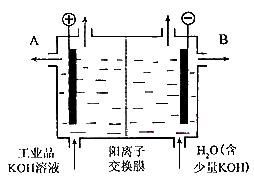
(1)该电解槽的阳极反应式是 。
(2)除去杂质后得氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
查看答案和解析>>
科目: 来源:2010—2011学年浙江省嘉兴一中高二下学期期中考试化学试卷 题型:填空题
(8分)目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。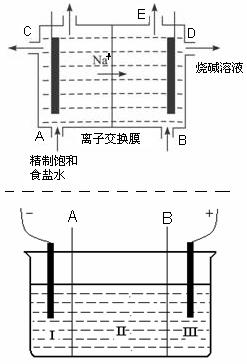
(1)下列说法不正确的是
| A.从E口逸出的气体是H2 |
| B.从B口加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH |
| D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com