
科目: 来源:2010-2011学年内蒙古赤峰二中高一下学期期中考试化学试卷 题型:实验题
(10分)请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气。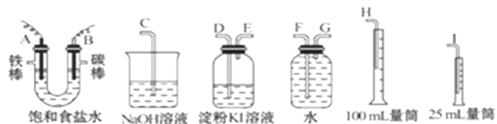
(1)A极发生的电极反应式是______ _______
_______  ______,
______,
B极发生的电极反应式是_______________________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接______、 _____接______ ;B接_____ 、 _____接______ 。
(3)证明产物中有Cl2的实验现象是______ 。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为:_____ ___。
查看答案和解析>>
科目: 来源:2010年江苏省南京市金陵中学高三上学期期中考试化学试题 题型:实验题
(18分)高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于饮用水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电化学法。
(1)电化学法制备高铁酸钠采用铁片作阳极,NaOH溶液作为电解质溶液,其电流效率可达到40%。写出阳极产生高铁酸钠的电极反应方程式: 。
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是 。研究亦发现,铁电极在某一电压范围内会产生氧气使阳极表面生成Fe2O3膜而“钝化”。写出产生O2的电极反应方程式: 。
(3)FeO42—易与水4h生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图中4h后)过滤掉氢氧化铁,反应过程中FeO42—浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是 (填编号)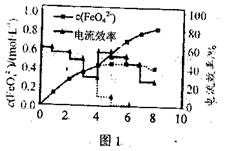
①过滤:掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
②过滤掉氢氧化铁对电流效率影响不大
③实验表明不过滤掉氢氧化铁,6h后电流效率几乎为0
(4)在相同的pH条件下,经过相同的反应时间,高铁酸盐的产率与温度关系如图2。
随温度升高,高铁酸盐产率先增大后减小的原因是 。
(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值有 (至少答一点)。
查看答案和解析>>
科目: 来源:2010年四川省南充高中高三上学期第一次月考(理综)化学部分 题型:实验题
(14分)如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验。试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色)。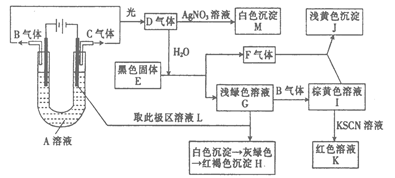
(1)A的化学式为 ,E的名称为 。
(2)I和F反应的离子方程式是 。
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是
,阳极的电极反应式为 ,阴极的电极反应式为 ,电解的化学方程式为 。
查看答案和解析>>
科目: 来源:2012-2013学年福建省晋江市季延中学高二下学期期中考试化学试卷(带解析) 题型:实验题
某课外活动小组同学用右图装置进行相关的实验,试回答下列问题。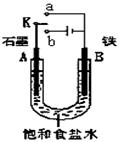
(1)若开始时开关K与a连接,则A极的电极反应式为 。
(2)若开始时开关K与b连接,则总反应的离子方程式为 。在该实验中,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后(设NaCl足量)加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则有0.2 mol电子转移
(3)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s) + H2O(g) =" CO(g)" + H2(g) △H > 0
B.NaOH(aq) + HC1(aq) =" NaC1(aq)" + H2O(1) △H < 0
C.2H2(g) + O2(g) = 2H2O(1) △H<0
(4)电解原理在化学工业中有着广泛的应用。右图中,a为电解液,X和Y是两块电极板,回答下列问题:
(4)①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为 。通过一段时间后,向所得溶液中加入8g CuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 。
查看答案和解析>>
科目: 来源:2012-2013学年四川省双流中学高二入学考试化学试卷(带解析) 题型:实验题
(12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的c(H+)均增小 |
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市十校联合体高二下学期期末考试化学试卷(带解析) 题型:实验题
(10分)如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失)。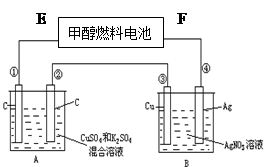
请回答下列问题:
(1)分别指出F电极、②电极的名称 、 。
(2)④电极的反应式: 。E电极的反应式: 。
①电极上产生的实验现象是 。
(3)若A池中原混合液的体积为500 mL,CuSO4、K2SO4浓度均为0.1 mol/L,电解过程中A池中共收集到标准状况下的气体 L。
查看答案和解析>>
科目: 来源:2012届广东省深圳高级中学高三上学期第一次测试理综试题(化学部分) 题型:实验题
(16分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,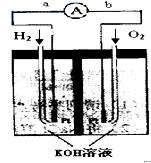
请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2="2LiH " Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目: 来源:2011年普通高等学校招生全国统一考试化学卷(江苏) 题型:实验题
 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在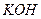 加入适量
加入适量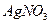 溶液,生成
溶液,生成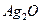 沉淀,保持反应温度为80,边搅拌边将一定量
沉淀,保持反应温度为80,边搅拌边将一定量 溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
溶液缓慢加到上述混合物中,反应完全后,过滤、洗剂、真空干燥得到固体样品。反应方程式为
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是 .
(2)银锌碱性电池的电解质溶液为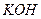 溶液,电池放电时正极的
溶液,电池放电时正极的 转化为
转化为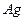 ,负极的
,负极的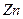 转化为
转化为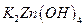 ,写出该电池反应方程式: .
,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设 仅含和
仅含和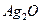 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为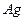 和
和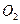 ,得到224.0mL
,得到224.0mL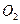 (标准状况下)。计算样品中
(标准状况下)。计算样品中 的质量分数(计算结果精确到小数点后两位)。
的质量分数(计算结果精确到小数点后两位)。
查看答案和解析>>
科目: 来源:2011届江苏省南京市金陵中学高三第四次模拟考试(理综)化学部分 题型:实验题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下: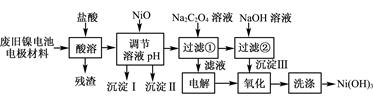
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | | |
| pH | | | |
| 开始沉淀 | 沉淀完全 | | |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
 ____(填化学式)。
____(填化学式)。 涤干净? 。
涤干净? 。查看答案和解析>>
科目: 来源:2011届浙江省嵊州二中高三12月月考化学试卷 题型:实验题
锂离子电池的广泛应用使回收利用锂资源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下: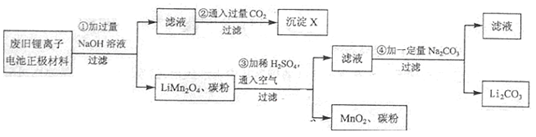
(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、 。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0mL 2.5mol·L-1的H2SO4溶液。正极材料中的锂经反应③和④完全转化为Li2CO3,至少有 g Na2CO3参加了反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com