
科目: 来源: 题型:解答题
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 装置 | 实验序号 | 试管中的药品 | 现象 |
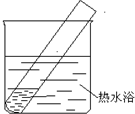 | 实验I | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生; 一段时间后,溶液逐渐变黑; 试管壁附着有银镜 |
| 实验II | 2mL银氨溶液和数滴浓氨水 | 有气泡产生; 一段时间后,溶液无明显变化 |
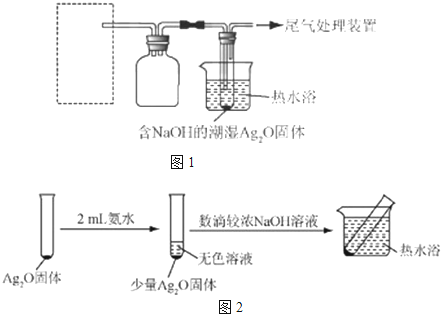
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
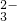 +H2O═HCO
+H2O═HCO +OH-
+OH-查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

查看答案和解析>>
科目: 来源: 题型:单选题
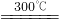 2HNO3+4N2↑+9H2O中,每生成4mol N2,转移电子数为15NA
2HNO3+4N2↑+9H2O中,每生成4mol N2,转移电子数为15NA查看答案和解析>>
科目: 来源: 题型:解答题
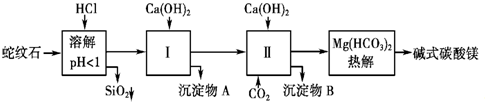
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
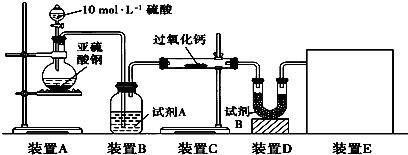
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com