
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 Fe3O4+nA↑+6S
Fe3O4+nA↑+6S查看答案和解析>>
科目: 来源: 题型:单选题
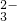 离子数为0.1NA
离子数为0.1NA查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
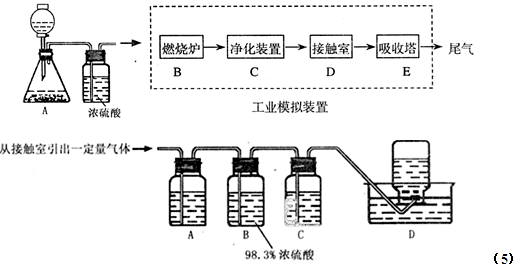
| 压强/Mpa 转化率 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度/g | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:单选题
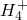 、Cl-、Mg2+、Ba2+、C
、Cl-、Mg2+、Ba2+、C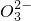 、S
、S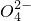 ,现取三份各100mL溶液进行如下实验:
,现取三份各100mL溶液进行如下实验: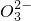
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com