
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
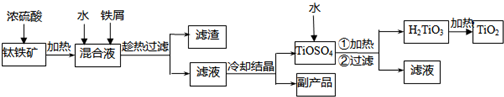
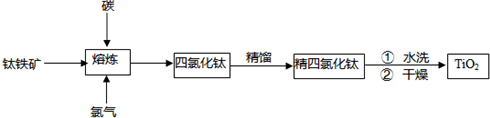
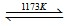 2TiCl4(l)+2FeCl3(s)+6CO(g)
2TiCl4(l)+2FeCl3(s)+6CO(g)查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:单选题
 Cu+Cl2↑
Cu+Cl2↑查看答案和解析>>
科目: 来源: 题型:解答题
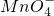 +5e-+8H+═Mn2++4H2O
+5e-+8H+═Mn2++4H2O查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
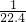 )mol/L
)mol/L查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法: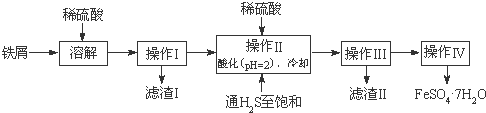
查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,可选用的试剂为______.
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是______;在溶液中用硫酸酸化至pH=2的目的是:______.
(3)操作IV的顺序依次为______、冷却结晶、______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com