
科目: 来源: 题型:单选题
| 序号 | 检验方法 | 结论 |
| A | 向一种未知溶液中加入BaCl2溶液,有白色沉淀生成 | 未知溶液中一定含有SO42- |
| B | 向一种未知溶液中滴加KSCN溶液,溶液变为红色 | 未知溶液中不含Fe2+ |
| C | 向一种未知溶液中加入盐酸酸化,然后再滴加AgNO3溶液,有白色沉淀生成 | 未知溶液中一定含有Cl- |
| D | 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 | 不能确定未知溶液中一定含有CO32- |
查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:单选题
 如图是化学实验室某试剂瓶标签上的部分内容.下列相关叙述错误的是
如图是化学实验室某试剂瓶标签上的部分内容.下列相关叙述错误的是查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| ______ | ______ |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目: 来源: 题型:解答题
 +______,
+______,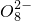 +H2O→Mn
+H2O→Mn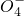 +S
+S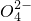 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去.
有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com