
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量品红溶液于试管中,再加入少量的______. | 若品红溶液褪色,则假设1成立. |
| 步骤2:______ ______ ______. | 若______,则假设2成立. |
| 根据步骤1、2. | 若______,则假设3成立. |
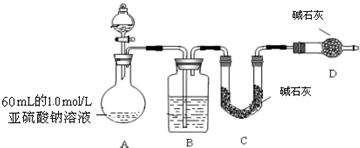
查看答案和解析>>
科目: 来源: 题型:单选题
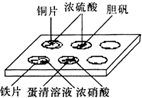 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的现象正确的是
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的现象正确的是查看答案和解析>>
科目: 来源: 题型:解答题
| 元 素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 地壳中含量最高的元素,A与B可形成一种质量比为 7:12的化合物(丙) |
| C | 单质曾用于焊接钢轨 |
| D | 单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
 A2B4(g);△H<0.在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭
A2B4(g);△H<0.在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭 容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com