
科目: 来源: 题型:单选题
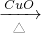 CO2
CO2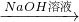 Na2CO3溶液
Na2CO3溶液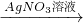 Cu(NO3)2溶液
Cu(NO3)2溶液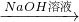 Cu(OH)2
Cu(OH)2 Fe2O3
Fe2O3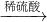 Fe2(SO4)3溶液
Fe2(SO4)3溶液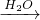 Ca(OH)2
Ca(OH)2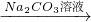 Naoh溶液
Naoh溶液查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
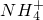 .
.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
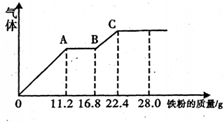 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解铜19.2g(已知硝酸只被还原为NO气体);向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.下列分析或结果错误的是
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解铜19.2g(已知硝酸只被还原为NO气体);向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.下列分析或结果错误的是查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: Si+2CO↑.
Si+2CO↑. SiCl4.
SiCl4. Si+4HCl.
Si+4HCl.查看答案和解析>>
科目: 来源: 题型:单选题
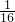 作为相对原子质量的标准,则NO2的相对分子质量是
作为相对原子质量的标准,则NO2的相对分子质量是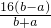
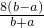
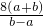
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com