
科目: 来源: 题型:解答题
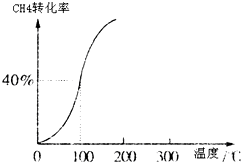 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义. ,其他条件不变,对平衡体系产生的影响是______(填字母序号).
,其他条件不变,对平衡体系产生的影响是______(填字母序号).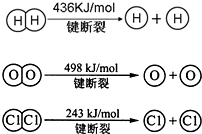
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:填空题
 2Fe+3CO2的中,________是氧化剂,________是还原剂,________元素被氧化,________元素被还原.用双线桥单线桥分别标出电子转移的方向和数目________。
2Fe+3CO2的中,________是氧化剂,________是还原剂,________元素被氧化,________元素被还原.用双线桥单线桥分别标出电子转移的方向和数目________。查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
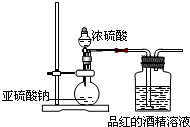 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面______ | 较上面______ | 较上面______ | 慢 |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A.______ | a.溶液pH=8 | i.______ |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b.______ | ii.S2O32一+2H+═ S↓+SO2↑+H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii.______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com