
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
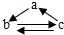 有a、b、c三种物质,它们之间通过一步反应就能实现如图所示的转化,则这三种物质的组合是
有a、b、c三种物质,它们之间通过一步反应就能实现如图所示的转化,则这三种物质的组合是 | A | B | C | D | |
| a | Fe | CuO | Ca(OH)2 | Si |
| b | FeCl3 | Cu(OH)2 | CaSO3 | Na2SiO3 |
| c | FeCl2 | CuCl2 | Ca(HSO3)2 | SiO2 |
查看答案和解析>>
科目: 来源: 题型:解答题
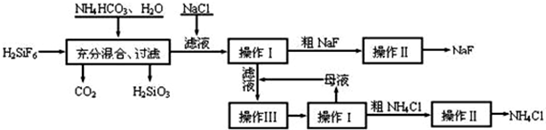
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 ,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图1所示(部分产物已略去):
,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图1所示(部分产物已略去):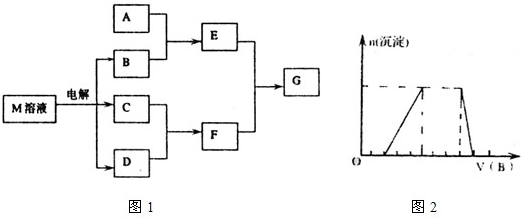
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
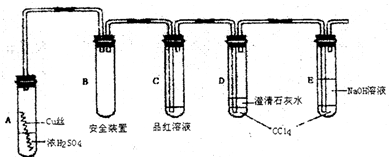
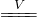 Cu2S(黑色)
Cu2S(黑色)查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com