
科目: 来源: 题型:单选题
 CO+H2
CO+H2查看答案和解析>>
科目: 来源: 题型:单选题
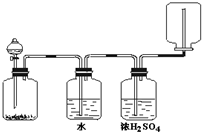 如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体.该装置可用于
如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体.该装置可用于查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
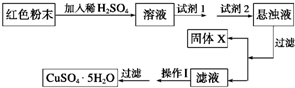 某校一化学实验小组通过实验分析,确定一红色粉末为Fe2O3和Cu2O的混合物.
某校一化学实验小组通过实验分析,确定一红色粉末为Fe2O3和Cu2O的混合物.| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | 供选择试剂 | |
| Fe3+ | 1.9 | 3.7 | A.氯水,B.H2O2, C.NaOH,D.氨水, E.CuO,F.Cu2(OH)2CO3 |
| Fe2+ | 7.5 | 11 | |
| Cu2+ | 6.0 | 10 |
查看答案和解析>>
科目: 来源: 题型:解答题
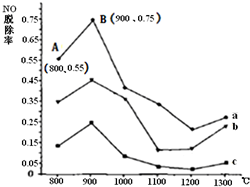 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.查看答案和解析>>
科目: 来源: 题型:单选题
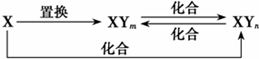 元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数).下列说法正确的是
元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数).下列说法正确的是查看答案和解析>>
科目: 来源: 题型:单选题
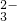 ═CO2↑+H2O
═CO2↑+H2O查看答案和解析>>
科目: 来源: 题型:解答题
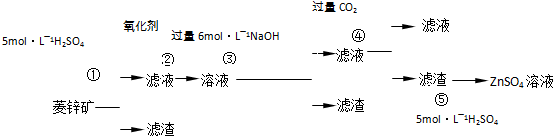
 BaS+CO↑
BaS+CO↑ BaS溶液
BaS溶液查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com