
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题

| 溶液 | 加入的物质 | 答案序号 |
| 饱和石灰水 | 通CO2至过量 | ________ |
| AlCl3溶液 | 通过量的NH3 | ________ |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ________ |
| NaAlO2溶液 | 滴加稀HCl至过量 | ________ |
| MgCl2 AlCl3的混和液 | 滴加NaOH至过量 | ________ |
查看答案和解析>>
科目: 来源: 题型:多选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
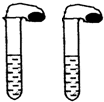 高中教材中有这样一个实验:在两支同样大小的试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
高中教材中有这样一个实验:在两支同样大小的试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:查看答案和解析>>
科目: 来源: 题型:单选题
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有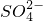 |
| B | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | SO2与Ba(NO3)2反应生成BaSO3 |
| C | 同温同压下,用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠发生了水解 |
| D | 向淀粉KI溶液中通入Cl2 | 溶液变蓝 | Cl2与淀粉发生显色反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
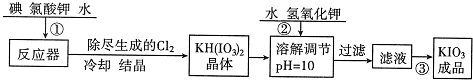
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL0.1 mol?L-1KI溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴1 mol?L-1的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
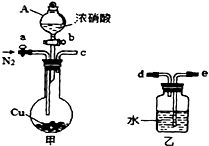 某化学课外小组利用如图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成.
某化学课外小组利用如图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com