
科目: 来源: 题型:解答题
 g
g
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
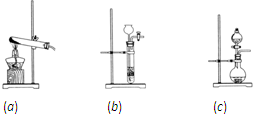
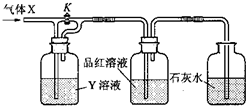 按下列实验装置(如图),通入气体X,当关闭K键时,品红溶液不褪色,石灰水变浑浊;当开启K键时,品红溶液褪色,则X气体与Y溶液应是
按下列实验装置(如图),通入气体X,当关闭K键时,品红溶液不褪色,石灰水变浑浊;当开启K键时,品红溶液褪色,则X气体与Y溶液应是| A | B | C | D | |
| X气体 | C12 | SO2 | CO2 | HCl |
| Y溶液 | NaCl | NaHCO3 | Na2SO3 | NaHSO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
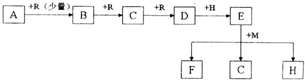
 某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应: 丙+丁+水.
丙+丁+水. MnO4-+
MnO4-+ SO2+
SO2+ ______=
______= Mn2++
Mn2++ SO42-+
SO42-+ H+
H+查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 2H2O+O2↑
2H2O+O2↑ CaSiO3
CaSiO3查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com