
科目: 来源:2011-2012学年浙江瑞安中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):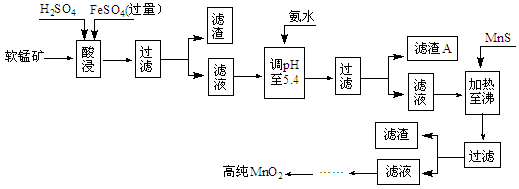
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | | |
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 | | |
查看答案和解析>>
科目: 来源:2011-2012学年福建省四地六校高一下学期第二次联考化学试卷(带解析) 题型:填空题
(5分).利用右图所示装置收集以下6种气体
(图中烧瓶的位置不得变化):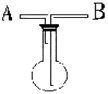
①NO ②Cl2③SO2 ④HCl ⑤NH3
⑴若烧瓶充满水,可收集的气体有 ,这时气体由 口进入(填序号)
⑵若烧瓶是干燥的,则由A口进气,可收集的气体有 。
⑶若在烧瓶中装入浓硫酸进行气体干燥,这时气体由 口进入,则不可用此装置来干燥的气体有 。
查看答案和解析>>
科目: 来源:2011-2012学年江苏省上冈高级中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下: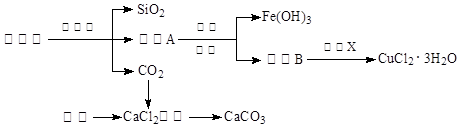
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目: 来源:2011-2012学年四川省南山中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(11分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的氧化物,实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下:
(1)写出Cu2(OH)2CO3在水中的沉淀溶解平衡方程式 ,溶液A的金属离子有Cu2+、Fe2+、Fe3+。检验溶液A中Fe3+的最佳试剂为 ,试剂①为 (从下列所给字母中选填,下同)
a.KMnO4 b.KI c.H2O2 d.KSCN
(2)写出溶液A到溶液B的离子方程式 _________
(3)试剂②是CuO,还可以是下列的 ,作用是 。
a.CuCl2 b.CuCO3 c.Cu(OH)2 d.CuSO4
(4)沉淀C的化学式为 。
查看答案和解析>>
科目: 来源:2011-2012学年浙江省温州市龙湾区龙湾中学高二期中考试化学试卷(带解析) 题型:填空题
(12分)某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
|
查看答案和解析>>
科目: 来源:2011-2012学年广西田阳高中高二3月月考理科化学试卷(带解析) 题型:填空题
(16分)下图中的实验装置可用于制取乙炔。请填空:
(1)图中,A管的作用是 。
制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
查看答案和解析>>
科目: 来源:2012届浙江省重点中学协作体高三3月调研理综部分(带解析) 题型:填空题
(15分)制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2。
II.对I中所得到的溶液按下列步骤进行提纯。
已知:
| | 氢氧化物开 始沉淀时的pH 始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
 。(填序号)
。(填序号) 。
。 ++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
查看答案和解析>>
科目: 来源:2011-2012学年山东济南平阴一中高一上学期期末检测化学试卷(带解析) 题型:填空题
(12分)某同学用10mol? L-1 的浓盐酸配制250mL 1mol? L-1 的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸____________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有________________、___________。
(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O。
Cl2↑+MnCl2+2H2O。
试回答下列问题:
该反应中_____________是氧化剂,氧化产物是_______________。
若产生标准状况下的Cl2 2.24L,则被氧化的HCl__________mol。
查看答案和解析>>
科目: 来源:2012届安徽省马鞍山市高三第一次教学质量检测理科综合试卷化学部分(解析版) 题型:填空题
(14分)KCIO3在农业上用作除草剂,超细CaCO3广泛用于生产牙膏、无炭复写纸等。某同学在实验室模拟工业生产,利用制乙炔产生的残渣制备上述两种物质,过程如下:
I.残渣中主要成分是Ca(OH)2和 。
II.将I中的部分灰浆配成浊液,通入Cl2在一定的温度下只得到Ca(ClO3)2与CaCl2两种溶质,该反应的化学方程式是 。
Ⅲ、向II所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得49.0克KClO3晶体,则理论上至少需要标准状况下Cl2 升。
Ⅳ、将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下: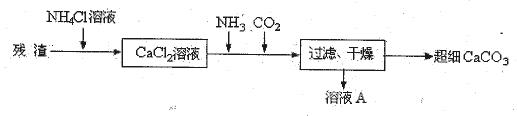
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因 。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是 。
③图示的溶液A可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目: 来源:2012年江苏省泰州中学高二学业水平测试模拟(3) 化学试卷 题型:填空题
(10分)⑴某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
则镁铝合金中加NaOH溶液的化学反应方程式为 ,金属X是 ,
固体A的化学式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
⑵某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称 ,需要测定的数据有 。(已知该实验时的温度压强)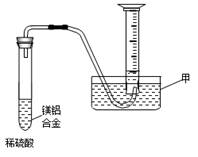
⑶现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为 mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com