
科目: 来源:2013届广东省汕头市潮阳一中高三上学期第一次月考理综化学试卷(带解析) 题型:填空题
(16分)过氧化氢(H2O2)有广泛的用途。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是:2NH4HSO4 (NH4)2S2O8+H2↑,
(NH4)2S2O8+H2↑,
(NH4)2S2O8+2H2O==2NH4HSO4 + H2O2。其流程如下:
回答下列问题:
(1)根据以上反应原理可知,电解硫酸氢铵溶液时,阴极的电极反应方程式是:
。
(2)在上流程图中,采用减压蒸馏的原因是: 。
可循环利用的物质是 。
(3)过氧化氢具有的化学性质是 。
| A.不稳定性 | B.弱碱性 | C.氧化性 | D.还原性 |
查看答案和解析>>
科目: 来源:2013届江西省南昌二中高三第一次考试化学试卷(带解析) 题型:填空题
(10分)晶体硅是一种重要的非金属材料。请写出晶体硅的二种用途:______、______
制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知:Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:___________。
Ⅱ.SiHCl3在空气中自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是______________,
②反应一段时间后,装置D中观察到的现象是 _ ,
装置D中发生反应的化学方程式为 ___ ,
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度
以及 _____________ ,
④设计鉴定产品硅中是否含少量Fe单质的方法:_________________________________。
查看答案和解析>>
科目: 来源:2013届江苏省徐州市高三模底考试化学试卷(带解析) 题型:填空题
(12分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是 。
(2)滤液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是 。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定
①配制250mL0. 标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
g.
②取上述制得的KMnO4产品0.316g,酸化后用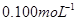 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: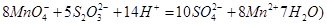
查看答案和解析>>
科目: 来源:2013届江苏省徐州市高三模底考试化学试卷(带解析) 题型:填空题
(12分)无水A1C13可用作有机合成的催化剂,食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水A1C13的流程如下
(1)在焙烧炉中发生反应:①

②

 。则反应②的平衡常数的表达式为K= 。
。则反应②的平衡常数的表达式为K= 。
(2)氯化炉中A12O3,C12和C在高温下反应的化学方程式为 ;其炉气中含有大量CO和少量C12,可用 溶液除去C12,并回收CO。
(3)升华器中主要含有A1C13和FeC13,需加入一定量A1,其目的是 。
(4)工业上另一种由铝灰为原料制备无水A1C13工艺中,最后一步是由A1C136H2O脱去结晶水制备无水A1C13,直接加热不能得到无水A1C13,其原因是 。已知SOC12为无色液体且极易与水反应生成HC1和SO2,A1C136H2O与SOC12混合加热可制取无水A1C13,写出该反应的化学方程式:
查看答案和解析>>
科目: 来源:2013届湖南省浏阳一中高考复习阶段测试化学试卷(带解析) 题型:填空题
(10分)CO是一种无色、无味且不溶于水的有毒气体,其制法有:
(1)实验室可用甲酸和浓 共热制取CO.
共热制取CO.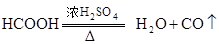
a.甲酸和浓 应怎样混合?浓
应怎样混合?浓 起什么作用?
起什么作用?
b.请据实验原理选择所需主要玻璃仪器(导管除外).
c.怎样收集CO气体?
(2)实验室还可用草酸晶体与浓 共热制取CO.
共热制取CO.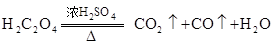
请问:怎样才能得到不含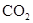 的CO气体?
的CO气体?
(3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:____________
____.在此条件下,C和 的还原性谁强?
的还原性谁强?
查看答案和解析>>
科目: 来源:2013届山东省德州市跃华学校高三暑假作业过关考试化学试卷(带解析) 题型:填空题
(13分)甲乙两位同学分别用不同的方法配制100 mL 3.6 mol·L-1的稀硫酸。
(1)若采用18 mol·L-1的浓硫酸配制溶液,需要用到浓硫酸的体积为__________。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是________________________________。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是__________________。
③定容的正确操作是___________________________________________________。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度线,处理的方法是________(填序号)。
| A.吸出多余液体,使凹液面与刻度线相切 |
| B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切 |
| C.经计算加入一定量的浓硫酸 |
| D.重新配制 |
查看答案和解析>>
科目: 来源:2013届新课标高三配套月考(一)化学试卷(B卷)(带解析) 题型:填空题
[2012·濮阳一模](7分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的化学方程式是 。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是
。
(3)若试剂1和试剂2均是稀硫酸。
①将物质C溶于水,其溶液呈 性(填“酸”、“碱”或“中”)。
②某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式为
。
查看答案和解析>>
科目: 来源:2011-2012学年河南省郑州市智林学校高一上学期期中考试化学试卷(带解析) 题型:填空题
(20分)下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500ml的操作,请按要求填空:
(1)所需浓H2SO4的体积为
(2)如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的 里,并不断搅拌,目的是 。
(4)将 的上述溶液沿 注入 中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要 中,并摇匀。
(5)加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平。
查看答案和解析>>
科目: 来源:2011-2012学年北京市朝阳区高一下学期期末统一考试化学试卷(带解析) 题型:填空题
(7分)金属镁的制取主要有两种途径,大约60%的镁是从海水中提取的,其余来自于含镁丰富的矿石,比如菱镁矿(主要成分为MgCO3)。从不同途径获得镁的流程如下:
回答下列问题:
(1)试剂a的化学式是__________。
(2)加入试剂b发生反应的离子方程式是__________。
(3)操作A是蒸发浓缩、冷却结晶、__________。
(4)在电炉中参加反应的n(Cl2):n(焦炭)=1:1,则该反应的化学方程式是__________。
(5)上述制镁的流程中,为降低成本、减少污染可采取的措施是__________。(写出一种即可)
查看答案和解析>>
科目: 来源:2011-2012学年浙江省宁波市八校高二下学期期末联考化学试卷(带解析) 题型:填空题
(10分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26. 02 | 25.35 | 25.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com