
科目: 来源:2011届贵州省铜仁一中高三第四次月考化学试卷 题型:填空题
某化学课外小组设计了如下图(铁架台均已略去)所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A表示一种纯净、干燥的气体,B表示另一种气体。反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:N a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
根据图中装置和反应现象请回答:
(1)丙中发生反应的化学方程式为 。
(2)丁中的干燥剂应选 ,不选另一种干燥剂的理由是 。
(3)甲中发生反应的化学方程式为  。
。
(4)戊中发生的主要反应的化学方程式为 ,此反应是(吸热、放热) 反应,可能发生的什么现象可以证明你的判断 。
查看答案和解析>>
科目: 来源:2011届河南省辉县市高三上学期第四次月考理综化学卷 题型:填空题
(16分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。


 相关信息如下:
相关信息如下: a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解; b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物; c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:

 请回答下列问题:
请回答下列问题: (1)写出装置A中发生反应的离子方程式 。
(1)写出装置A中发生反应的离子方程式 。 (2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:

 ①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
查看答案和解析>>
科目: 来源:2010年北京东城区高三上学期化学综合练习(一) 题型:填空题
用如下装置可以完成一系列实验(图中夹持装置已略去)。
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | | | 褪色[来源:学科网ZXXK] | 浅黄色 |
| 体现SO2的性质 | | | | |
查看答案和解析>>
科目: 来源:2011届广东省深圳市高级中学高三上学期第三次测试(理综)化学部分 题型:填空题
硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下: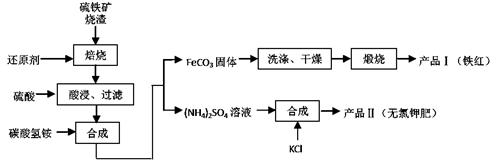
已知几种盐的溶解度随温度变化的
曲线如右图所示: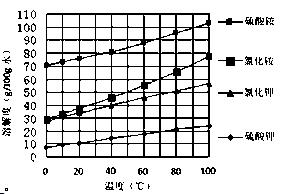
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧 FeCO3生成产品 I的化学反应方程式为 _______。
实验室进行煅烧操作所需仪
器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向 (NH4) 2SO4溶液中加入KCl溶液后,还需要进行的操作是:。
2SO4溶液中加入KCl溶液后,还需要进行的操作是:。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
查看答案和解析>>
科目: 来源:2010年河北省黄骅中学高二上学期期中考试化学试卷 题型:填空题
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下:
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | D | 氨水 |
| B | 高锰酸钾 | E | 碱式碳酸铜 |
| C | 氯水 | F | 氧化铜 |
查看答案和解析>>
科目: 来源:2010年吉林省长春十一中高二上学期期中考试化学试卷 题型:填空题
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下: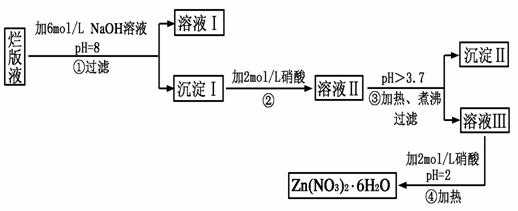
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式_____________________________。
(2)在操作①中保持pH=8的目的是____________________________。
(3)沉淀Ⅰ的主要成分是_______________________________________。
(4)操作③中加热、煮沸的目的是________________________________;
此步骤操作的理论依据是____________________________________。
(5)操作④保持pH=2的目的是__________________________________;
此步骤操作中所用的主要仪器是________________________________。
查看答案和解析>>
科目: 来源:2010年福建省厦门六中高二上学期期中考试化学试卷 题型:填空题
某同学在用稀盐酸与铁制取氢气的实验中,发现加入少量氯化铜溶液可加快氢气的生成速率。请回答下列问题:
(1)要加快上述实验中气体产生的速率,还可采取的措施有
(答两种);
(2)实验室中现有NaCl、CuSO4、FeCl2、ZnCl2等4种溶液,可与实验中CuCl2溶液起相似作用的是 ;
(3)为了进一步研究氯化铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验(混合溶液) | A | B | C | D | E | F |
| 4mol/L 盐酸/mL | 60 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuCl2溶液/mL | 0 | 1.0 | 5.0 | 10 | V6 | 40 |
| H2O/mL | V7 | V8 | V9 | V10 | 20 | 0 |
查看答案和解析>>
科目: 来源:2010年湖北省孝感高中高二上学期期中考试化学试卷 题型:填空题
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有 。
(2)取10.00mL待测液,用 式滴定管量取。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定到终点。
(4)根据下列数据,烧碱的纯度为 。
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 来源:2011届福建省厦门市双十中学高三上学期期中考试化学试卷 题型:填空题
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式 ,有人认为合金与烧碱溶液形成了原电池,则作为原电池负极的物质是 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是 。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有 和玻璃棒;其中玻璃棒的作用是 。
(3)用粗制氧化铜通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、 。
(4)通过途径④实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。其中“加热通氧气”所起的作用为 (用离子方程式表示)。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。若测定结果x值偏高,可能的原因是 。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
e.加热时胆矾晶体飞溅出来 f.所用坩埚事先未干燥(潮湿)
查看答案和解析>>
科目: 来源:2010年江苏省盐城中学高一上学期期中考试化学试卷 题型:填空题
已知HClO  H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
H++ClO-,为了探究HClO的漂白性,甲同学设计了如下的实验。
(1)通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此甲同学认为:干燥的氯气 漂白性,潮湿的氯气 漂白性(填“有”或“没有”)。
(2)细心的乙同学发现,一段时间后干燥的有色布条也褪色了。他经过仔细思考,认为甲的设计有缺陷,应该作如下修改: 。
(3)烧杯中NaOH溶液所起的作用是 ,
烧杯中所发生反应的化学方程式为 。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时5分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为 mL。
(5)丙同学按照乙同学的方案修改后,补做了盐酸加入到有色布条,发现有色布条不褪色。丙同学确认是HClO使有色布条褪色,但丁同学认为还是不能确认HClO使湿润的有色布条褪色,他认为还应增加的实验是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com