
科目: 来源:2011届黑龙江省哈三中等四校高三第一次高考模拟联考(理综)化学部分 题型:实验题
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: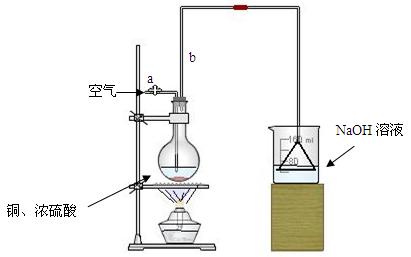
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
⑵烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
查看答案和解析>>
科目: 来源:2011届宁夏银川一中高三第一次模拟考试(理综)化学部分 题型:实验题
(15分)
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。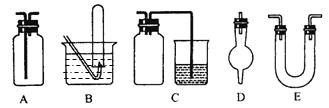
请回答下列问题:
⑴能用作干燥氨气的装置有___________(填字母);
⑵既能用于收集氯气又能用于收集一氧化氮气体的装置有____________(填字母);
⑶在氯气和铁反应实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有____________(填字母);
⑷能用于乙烯与溴水反应制二溴乙烷的实验装置有_____________(填字母);
⑸若用C装置作二氧化硫与烧杯中氢氧化钠溶液反应的实验,则其中广口瓶的作用是________________________________________________________________。
⑹为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。
①可通过观察 现象来定性比较得出
结论。
②有同学提出将CuSO4改为CuCl2更为合理,其理由是 ;
你认为还可以作何改进?
﹒
查看答案和解析>>
科目: 来源:2011届浙江省苍南中学高三上学期期中考试化学试卷 题型:实验题
(12分)北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB54 61 61 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 | |
 程式是 。
程式是 。 某学生设计回收四氯化碳的操作步骤为:
某学生设计回收四氯化碳的操作步骤为:查看答案和解析>>
科目: 来源:2010—2011学年福建省安溪一中、养正中学高一上学期期末联考化学试卷 题型:实验题
(12分)某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究。请按要求完成下列研究报告。
[资料获悉]36.5%的浓盐酸的密度为1.19 g·cm-3。
[探究思路]用1.00 mol·L-1的稀盐酸测定样品溶液的组成。
[实验探究]用36.5%的浓盐酸配制100 mL 1.00 mol·L-1的稀盐酸需要的玻璃仪器有烧杯、玻璃棒、量筒、 。
取20.0 mL样品溶液不断加入1.00 mol·L-1的稀盐酸,加入盐酸的体积和产生的现象见下表。
| 反应阶段 | I | II | III |
| 盐酸体积x/ mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 有气体 | 无气体 |
 是称量和 ,在实验中需要测定的数据有 。
是称量和 ,在实验中需要测定的数据有 。查看答案和解析>>
科目: 来源:2011届广西河池高级中学高三第六次月考理综化学部分 题型:实验题
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均 不带结晶水)
不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为 ;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 、 、 。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。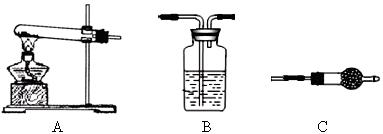
(1)各装置连接顺序为 → → 。
(2)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。

(1)装置C中碱石灰的作用是 ,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为 。
查看答案和解析>>
科目: 来源:2011届山西大学附中高三2月月考(理综)化学部分 题型:实验题
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答: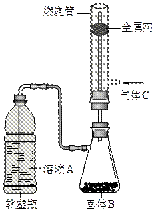
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。
| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | _______________ | 棉球变白,微热后又恢复红色 | 解释:__________________ 结论:该气体具有漂白性。 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: _________________________ |
| c | 淀粉和___________的混合溶液 | 棉球变为白色 | 化学方程式:_________________ 结论:该气体具有_________性。 |
| | 溶液A | 固体B | 气体C |
| a. | 稀硫酸 | Zn | Cl2 |
| b. | 浓盐酸 | MnO2 | H2 |
| c. | 稀硝酸 | Fe | Cl2 |
| d. | 浓盐酸 | KMnO4 | H2 |
查看答案和解析>>
科目: 来源:2010—2011学年浙江省宁波市八校联考高二上学期末化学试卷 题型:实验题
(14分)某化学兴趣小组用下图所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。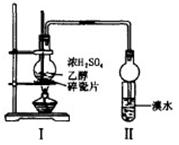
⑴写出该实验中生成乙烯的化学方程式:
⑵甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 (填字母序号)
A、乙烯与溴水易发生取代反应
B、使溴水褪色的反应,未必是加成反应
C、使溴水褪色的物质,未必是乙烯
D、浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
⑶乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是
⑷丙同学对上述实验装置进行了改进,在I和II之间增加如图装置,则A中的试剂应为 ,其作用是 ,B中的试剂为 。
⑸处理上述实验后烧瓶中废液的正确方法是 (填字母序号)。
A、废液冷却后倒入下水道中
B、废液冷却后倒入空废液缸中
C、将水加入烧瓶中稀释后倒入废液缸
查看答案和解析>>
科目: 来源:2011届山东省济宁一中高三第一次模拟测试试题理综化学试卷 题型:实验题
(12分)乱扔废旧电池会导致严重的环境污染,一节废电池就是一颗“炸弹”。某化学兴趣小组的同学在探究废干电池内的黑色固体回收利用时,进行了如图所示的实验:
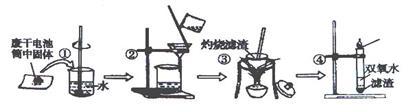
查阅教材可得到下列信息:
①普通锌锰电池的黑色物质主要成分为MnO2.NH4Cl.ZnCl2等物质。
②Zn(OH)2能溶解于过量的氨水中。
请回答以下问题:
(1)操作③灼烧滤渣时所用到的主要仪器有酒精灯.玻璃棒. .泥三角和三脚架;灼烧滤渣中的黑色固体时,产生一种使澄清的石灰水变浑浊的气体,由此推测滤渣中还存在碳。
(2)操作④的试管中加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为 。
(3)该同学对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 | 操作 | 实验现象 | 结论 |
| 检验Cl- | 取少许滤液于试管中, | | 含有Cl- |
| 检验NH4+ | 取少许滤液于试管中, | | 含有NH4+ |
| 检验Zn2+ | 取少许滤液于试管中, | | 含有Zn2+ |
查看答案和解析>>
科目: 来源:2011届江西省重点中学联盟高三第一次联考理综化学部分 题型:实验题
(15分)[实验探究]已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。
完成以下实验探究过程:
[提出假设]
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
[设计实验方案]
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
验证假设1的方案:
本方案所用到的主要玻璃仪器有: 。
验证假设2的方案: 。
(2)根据高中所学的知识判断,你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉-碘化钾溶液验证你的假设是否可行? (填“可行”或“不可行”),理由是 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为 。
查看答案和解析>>
科目: 来源:2010—2011学年福建省福州市第八中学高二上学期期末考试化学试卷 题型:实验题
(16分)某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与活动并完成下列研究:
(1)制取氨气
①实验室制备氨气,下列方法中适宜选用的是 (填编号);
a.氯化铵溶液与氢氧化钠溶液共热;b.固体氢氧化钠中滴加浓氨水;c.固态氯化铵加热分解;d.固态硝酸铵加热分解;f.固态氯化铵与熟石灰混合加热。
②写出实验室制取氨气的化学方程式 。
(2)实验探究
该小组成员设计实验探究氨气的还原性及其产物,提供实验装置如下:
|
 ①请你根据提供的装置从左至右连接接口序号( )()( )( )( )( )
①请你根据提供的装置从左至右连接接口序号( )()( )( )( )( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com