
科目: 来源:2012届河南省豫南九校高三上学期第一次联考化学试卷 题型:实验题
(9分)、已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃
⑴装置Ⅱ的试管中不装任何试剂,其作用是 。试管浸泡在50℃的水浴中,目的是 。
| 检验试剂 | 预期现象与结论 |
| 装置Ⅲ的试管中加入 。 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中加入 。 |  |
 Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。限选试剂:3mol·L-1H2SO4、6 mol·L-1NaOH、0.5 mol·L-1BaCl2、0.5 mol·
Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。限选试剂:3mol·L-1H2SO4、6 mol·L-1NaOH、0.5 mol·L-1BaCl2、0.5 mol· L-1Ba(NO3)2、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水
L-1Ba(NO3)2、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水查看答案和解析>>
科目: 来源:2012届山西省高三第一次阶段性诊断考试化学试卷 题型:实验题
(10分)某课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题:
(1) 写出用铜与稀硝酸反应制取一氧化氮的离子方程式: ________________
(2)查阅资料 得知:
得知: 。实验室有如图所示的装置.则制取一氧化碳可选用的装置为________________(填字母)。
。实验室有如图所示的装置.则制取一氧化碳可选用的装置为________________(填字母)。
(3)汽车尾气是当前城市大气污染的主要来源之一.汽车尾气中的主要污染物为一氧化碳和氮氧化物。汽车尾气催化转化装置可将这些有害气体转化为无害物质。该小组设计了如图所示的装置(部分夹持装置已略去).在实验室模拟汽车尾气处理的过程。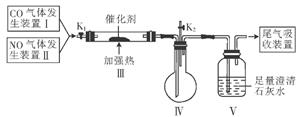
①实验前关闭K2,打开K1从K1处先通氮气排净装置中的空气,其目的是________
②装置III内发生反应的化学方程式为________
③实验过程中,装置V内可观察到的现象是________________
④实验结束后,关闭K1, 停止加热,打开K2,通入适量空气后,装置IV中可观察到有红棕色气体生成.该气体是________________(填化学式)。
停止加热,打开K2,通入适量空气后,装置IV中可观察到有红棕色气体生成.该气体是________________(填化学式)。
查看答案和解析>>
科目: 来源:2012届四川省绵阳南山中学高三九月诊断考试理综试卷(化学部分) 题型:实验题
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: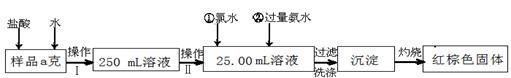
请根据上面流程,回答以下问题:
(1)操作I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有 (填自选仪器名称),操作II 必须用到的仪器是 (从以下选项中选择,填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
查看答案和解析>>
科目: 来源:2012届高三上学期九月份月考化学试卷(必修1第1-3章部分内容) 题型:实验题
(10分)Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设 假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究: 取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是___________ 。
(3)进一步探究:完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
| 实验步骤 | 预期现象和结论 |
| | |
查看答案和解析>>
科目: 来源:2012届河北省定州二中高三第一次月考化学试卷 题型:实验题
(18分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题: Fe3+、Br2哪一个的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| | 选用试剂 | 实验现象 |
| 方案1 | | |
| 方案2 | | |
查看答案和解析>>
科目: 来源:2012届高考化学一轮复习《化学实验基础》专题综合测试(苏教版) 题型:实验题
(11分)化学兴趣小组设计以下实验方案,测定已部分变质的某小苏打样品中Na2CO3的质量分数。
[方案一]称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
________________________________________________________________________。
(2)实验中需加热至恒重的目的是:
________________________________________________________________________。
(3)实验中确定加热至恒重的方法是:
________________________________________________________________________。
(4)若加热过程中坩埚内有晶体迸溅出来,则测得的结果________(填“偏大”、“偏小”或“不变”)。
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-===BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为______________。
(2)实验中判断沉淀是否完全的方法是
________________________________________________________________________________________________________________________________________。
(3)实验中洗涤沉淀的操作是
________________________________________________________________________。
(4)实验中判断沉淀是否洗涤干净的方法是
_______________________________________________________________________________________________________________________________________________。
[方案三]
按如图所示装置进行实验: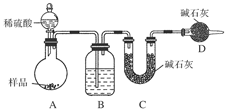
(1)B装置内所盛试剂是________;D装置的作用是______________;分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:____________________。
查看答案和解析>>
科目: 来源:2012届高考化学一轮复习《化学实验基础》专题综合测试(苏教版) 题型:实验题
(8分)(2011·西宁模拟)甲醛是世界卫生组织(WHO)确认的致癌物质和致畸物质之一。我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组打算利用酸性KMnO4溶液测定新装修房屋内的空气中甲醛的含量,请你参与并协助他们完成相关的学习任务。
测定原理:
酸性KMnO4为强氧化剂,可氧化甲醛和草酸,其反应方程式如下所示:
4MnO4-+5HCHO+12H+===4Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
测定装置:
部分装置如下图所示: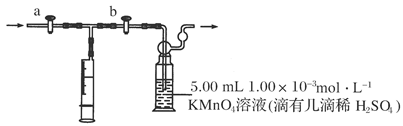
测定步骤:
(1)用______________量取5.00 mL 1.00×10-3mol·L-1KMnO4溶液,注入洗气瓶中,并滴入几滴稀H2SO4,加水20 mL稀释,备用。
(2)将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
(3)打开a,关闭b,用注射器抽取100 mL新装修房屋内的空气。关闭________,打开________(填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次。
(4)将洗气瓶中的溶液转移到锥形瓶中(包括洗涤液),再用草酸标准溶液进行滴定,记录滴定所消耗的草酸标准溶液的体积。
(5)再重复实验2次(每次所取的高锰酸钾溶液的体积均为5.00 mL)。3次实验所消耗的草酸标准溶液的体积平均值为12.38 mL。
交流讨论:
(1)计算该新装修房屋内的空气中甲醛的浓度为________mg·m-3,该新装修房屋内的甲醛________(填“是”或“否”)超标;
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设称量或量取、溶液配制及滴定实验均无错误)提出合理假设:______________、______________(至少答出两种可能性);
(3)实验结束后,该小组成员在相互交流的过程中一致认为:
①实验原理可以简化
实验中可不用草酸标准溶液滴定,可多次直接抽取新装修房屋内的空气,再推送到洗气瓶中,直至_________________________________________________________;
②实验装置应加以改进
可将插入酸性KMnO4溶液中的导管下端改成具有多孔的球泡(如图所示),有利于提高实验的准确度,其理由是___________________________________________________。
查看答案和解析>>
科目: 来源:2012届广东省揭阳第一中学高三上学期摸底考试理综卷(化学部分) 题型:实验题
(14分)
Fe2O3和Cu2O都是常用的红色颜料。某红色粉末可能含有Fe2O3和Cu2O,某化学实验小组通过实验来探究该红色粉末的成分。已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
(1)提出假设
假设1:红色粉末只含Fe2O3;
假设2:_______________________________;
假设3:红色粉末是Fe2O3和Cu2O的混合物。
(2)初步探究
取少量红色粉末于小烧杯中,放入足量稀硫酸,充分搅拌后粉末全部溶解(温馨提示:Cu+2Fe3+=Cu2++2Fe2+)。上述三个假设中,可能成立的是____________________。
(3)进一步探究
完成后续实验方案的设计,填写下表中实验步骤、预期实验现象和结论(可不填满,也可补充)。
限选实验试剂:3 mol·L—1 H2SO4、3 mol·L—1 NaOH、0.01 mol·L—1 KMnO4、20% KSCN、3%H2O2、淀粉-KI溶液。
| 实验步骤 | 预期现象和结论 |
| | |
| | |
查看答案和解析>>
科目: 来源:2012届吉林省吉林市普通高中高三上学期摸底测试化学卷 题型:实验题
(14分)某研究性学习小组的同学利用下图来验证一定质量的铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数,已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。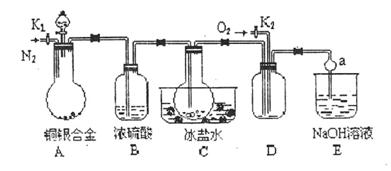
(1)写出A中铜与硝酸反应的一个化学方程式 ;
(2)C装置的作用是 ;
(3)反应结束后,打开活塞K2,并通入O2,若 实验中有NO产生,则在D中可观察到的现象是 ;
实验中有NO产生,则在D中可观察到的现象是 ;
(4)反应前要先打开活塞K1持续通入一段时间的N2,其理由是 ;
(5)利用A装置中反应后的溶液还可确定铜的质量分数,方法是:取出A中反应后的溶液,先向其中加入足量的 溶液,然后再进行 , ,  , 。(填操作名称)
, 。(填操作名称)
查看答案和解析>>
科目: 来源:2012届高三上学期化学一轮复习《硫、氮和可持续发展》专题综合测试(苏教版) 题型:实验题
(11分)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:
(1)测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为________mol,则Ag与浓硝酸反应过程中生成的NO2体积为________mL。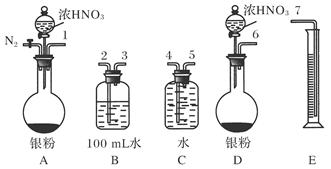
(2)测定NO的体积
①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是______________________________________________________________________
________________________________________________________________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是________(填各导管口编号)。③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置________(选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO产生,作此判断的依据是
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com