
科目: 来源:2013届山西省山西大学附属中学高三10月月考化学试卷(带解析) 题型:实验题
.利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
(A) (B) (C)
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
① 、② 、③ 、④ 、⑤ 、⑥ 、⑦ .
(2)实验中使用了空气,其作用是 ;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量 (填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是 ,若缺乏干燥管Ⅱ,其后果是 .
(4)若分液漏斗中④的滴液速度过快,将导致实验结果 (填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为 。
查看答案和解析>>
科目: 来源:2013届浙江省嘉兴一中高三10月月考化学试卷(带解析) 题型:实验题
(共14分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
[探究二]
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。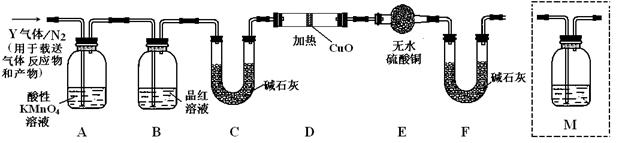
(3)装置B中试剂的作用是
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是
查看答案和解析>>
科目: 来源:2013届湖南省衡阳八中高三第二次月考化学试卷(带解析) 题型:实验题
(14分)某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 ;
(2)乙同学认为有Cu(OH)2生成的理论依据是 (用离子方程式表示);
(3)两同学利用下图所示装置进行测定
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥;
②装置E中碱石灰的作用是 ;
③实验过程中有以下操作步骤: a.关闭K1、K3,打开K2、K4,充分反应 b.打开K1、K4,关闭K2、K3,通入过量空气c.打开K1、K3,关闭K2、K4,通入过量空气。正确的顺序是 (填选项序号,下同);若未进行步骤 ,将使测量结果偏低;
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为 ;
查看答案和解析>>
科目: 来源:2013届辽宁省沈阳铁路实验中学高三第一次月考化学试卷(带解析) 题型:实验题
(每空3分共计21分)
某学习小组用图示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(4)B中发生反应的化学方程式为
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 (填“偏大”“偏小”或“不受影响”)。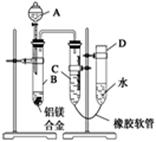
查看答案和解析>>
科目: 来源:2012届江西省南昌三中高三第三次月考化学试卷(带解析) 题型:实验题
某校化学小组的同学开展K2CO3和NaCl的固体混合物中K2CO3的检验与质量分数测定的探究实验,他们提出下列实验方案。
(一)补全以下检验混合物中存在K2CO3的实验步骤及相关现象
(1)取混合物样品溶于水,分别取少量溶液进行以下实验
(2)_________________________________________则一定存在K+;
(3)___________________________________________________则一定存在CO32—。
(二)测定K2CO3质量分数
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时检查该装置气密性的方法是 。
(2)乙同学用图2代替图1中的收集装置,则所测K2CO3质量分数 (填“偏大”、“偏小”、“不变”),你的改进方案是 。
(3)丙同学用图3装置测定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你填写其中的三点缺陷:I ;Ⅱ ;Ⅲ
查看答案和解析>>
科目: 来源:2013届吉林省松原市油田高中高三8月底摸底考试化学试卷(带解析) 题型:实验题
(10分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):(a)→()()→()()→()()→()()→()()→(l)
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
查看答案和解析>>
科目: 来源:2013届广西省武鸣高中高三8月月考理综试卷(带解析) 题型:实验题
(14分)某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物(水除外),他们设计的实验装置如下图所示: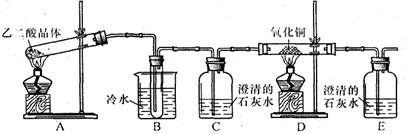
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式: ;
(2)装置B的作用是 ;指出上述装置中的不足之处: 。
(3)实验结束后向装置B的试管中加入少量酸性高锰酸钾溶液,可以观察到的实验现象是溶液由褪色,反应的离子方程式为 。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组进一步探究:
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是 。
②取该红色固体与足量的稀硝酸反应,写出反应的化学方程式 。
查看答案和解析>>
科目: 来源:2013届山东省青州一中高三10月阶段测试化学试卷(带解析) 题型:实验题
(12分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: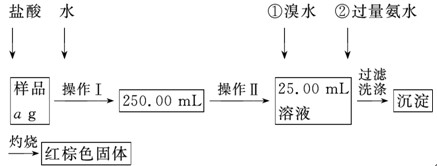
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称),操作Ⅱ必须用到的仪器是________(填编号)。
| A.50 mL烧杯 | B.50 mL量筒 | C.100 mL量筒 | D.25 mL滴定管 |
查看答案和解析>>
科目: 来源:2013届浙江省温州八校高三9月期初联考化学试卷(带解析) 题型:实验题
(12分)实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。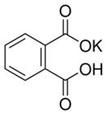
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
查看答案和解析>>
科目: 来源:2013届山西省长治二中高三上学期第一次练考化学试卷(带解析) 题型:实验题
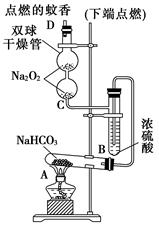
(10分)如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
(1)在A试管内发生反应的化学方程式是_____ ___。
(2)B装置的作用是___________________ _________。
(3)在双球干燥管内发生反应的化学方程式为________________。
(4)双球干燥管内观察到的实验现象是______________________;上述实验现象说明:________ _______________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是:
______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com