
科目: 来源:2012-2013学年黑龙江友谊县红兴隆第一高级中学高二6月月考化学卷(带解析) 题型:实验题
某研究性学习小组做了以下实验:向溴水中加入足量乙醛溶液,观察到溴水褪色的现象。
(1)[提出问题]
产生上述现象的原因是什么?
(2)[提出猜想]
①溴水与乙醛发生取代反应。
②___________________________________________________。
③___________________________________________________。
(3)[设计方案]
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
(4)[实验探究]
取含0.005mol Br2的溶液10mL,加入足量乙醛溶液使其褪色,再加入过量AgNO3溶液,过滤、洗涤、干燥后称重固体质量为1.88g。
(5)[解释与结论]
假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=0 mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=a mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=2a mol,则说明溴水与乙醛发生了____________反应。
若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为___________。理由是________________________________________。
其反应的离子方程式为__________________________________________________。
(6)[反思与评价]
方案一是否可行?__________。理由是_______________________________。
查看答案和解析>>
科目: 来源:2012-2013学年黑龙江友谊县红兴隆第一高级中学高二6月月考化学卷(带解析) 题型:实验题
碳酸氢铵是一种重要的铵盐。实验室中,将二氧化碳通入氨水可制得碳酸氢铵,用碳酸氢铵和氯化钠可制得纯碱。完成下列填空:
(1)二氧化碳通入氨水的过程中,先有________晶体(填写化学式)析出,然后晶体溶解,最后析出NH4HCO3晶体。
(2)粗盐(含Ca2+、Mg2+)经提纯后,加入碳酸氢铵可制得碳酸钠。实验步骤依次为:①粗盐溶解;②加入试剂至沉淀完全,煮沸;③_______;④加入盐酸调pH;⑤加入__________;⑥过滤;⑦灼烧,冷却,称重。
(3)上述步骤②中所加入的试剂为_____________、____________。
(4)上述步骤④中加盐酸调pH的目的是________________________。
查看答案和解析>>
科目: 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷带解析) 题型:实验题
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目: 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷带解析) 题型:实验题
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
工业ZnO 浸出液
浸出液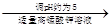
 滤液
滤液
 滤液
滤液
 滤饼
滤饼 ZnO
ZnO
提示:在本实验条件下,Ni(Ⅱ)不能被氧化,高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为 。
加高锰酸钾溶液前,若pH较低,对除杂的影响是 。
(2)反应③的反应类型为 ,过滤得到的滤渣中,除了过量的锌外还有 。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是 。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于 。
查看答案和解析>>
科目: 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷带解析) 题型:实验题
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。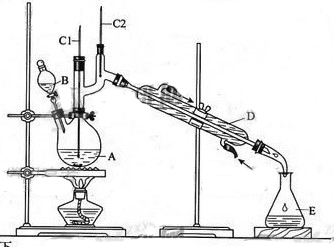
发生的反应如下:
CH3CH2CH2CH2OH CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目: 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷带解析) 题型:实验题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…… ⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置B中的冷水作用为 ;装置C的名称为 ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂: 。
(5)在虚线框内画出尾气吸收装置E并注明试剂
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;② 。
查看答案和解析>>
科目: 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷带解析) 题型:实验题
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下: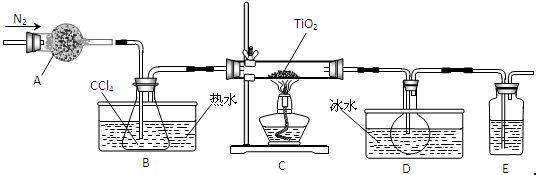
有关物质性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
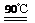 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq) 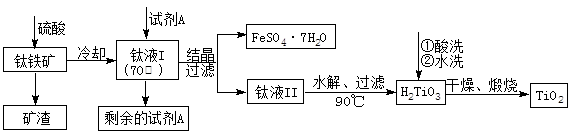
查看答案和解析>>
科目: 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(广东卷带解析) 题型:实验题
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是 。
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
查看答案和解析>>
科目: 来源:2012-2013学年四川省资阳市高一上学期期末质量检测化学试卷(带解析) 题型:实验题
某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
(1)假设3: 。
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是
;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设 成立;若出现血红色,则假设 成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现
现象,则假设1成立;反之,则假设3成立。
(5)某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论,该结论是否合理? (填“是”或“否”),理由是 。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省江都市大桥中学高二下学期期末考试化学试卷(带解析) 题型:实验题
两位同学设计了下述两个方案, 并都认为如果观察到的现象和自己所设计的方案一致,即可确定无色气体中一定含有SO2和CO2气体。

请你评价上述两个方案是否严密,并说明理由。
方案甲:_________,______________________
方案乙:_________,_______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com