
科目: 来源:2010年北京市八一中学高二第二学期期末考试化学试卷 题型:实验题
(15分)某实验小组同学对电化学原理进行了一系列探究活动。
(1)右图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,一段时间后,两电极质量相差12g,导线中通过 mol电子。
(2)其它条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为 ,这是由于NH4Cl溶液显 性,(填酸性、碱性或中性)用离子方程式表示溶液显此性的原因 ,用吸管吸出铁片附近溶液少许至于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是 ,电极反应为 ;乙装置中石墨(1)为 极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为 ,产物常用 检验,反应的离子方程式为 。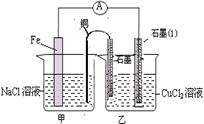
查看答案和解析>>
科目: 来源:2010年上海市闵行区高一第二学期质量调研考试化学试卷 题型:实验题
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答下列问题:
(1)装置A中发生的化学反应方程式为___________________________。
在此反应中,浓硫酸所体现的主要性质是______(填序号)
A酸性 B强氧化性 C脱水性 D吸水性 E强腐蚀性 F不挥发性
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_____________,其作用是_________________________ 。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。
B中应放置的液体是(填字母)__________________。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
查看答案和解析>>
科目: 来源:2010年高考化学试题分项专题十五 化学实验 题型:实验题
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么 (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量 m(H20),由此计算
m(H20),由此计算 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):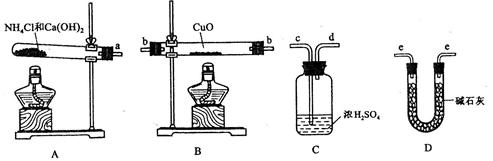
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)=" a" g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大 的是_______________ (填序号);
的是_______________ (填序号);
1Cu0未完全起反应 ② CuO不 干燥
干燥
3Cu0中混有不反应的杂质 ④碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________ _____和_______________达到实验目的。
_____和_______________达到实验目的。
查看答案和解析>>
科目: 来源:2010年江苏省淮州中学高二下学期期末考试化学 题型:实验题
(14分)某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4?7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。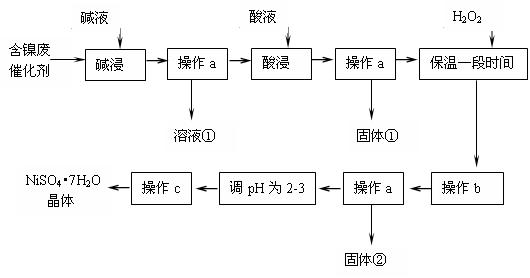
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目: 来源:2010年广州市执信中学等四校联考高一第二学期期末考试化学试题 题型:实验题
(15分)广义的化学反应速率可以用参加化学反应的任一种物质“在单位时间内某一可测的物理量的变化量”来表示,即V(A) = 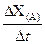 ,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。
,rX(A)表示物质A物理量(如质量、浓度等)的改变量。某学习小组用块状纯锌和200mL稀硫酸反应研究化学反应速率,实验装置图如右图。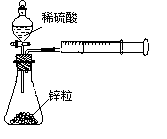
可选用试剂及规格:纯锌、粗锌(含铜杂质)、1mol/L 稀硫酸、2mol/L 稀硫酸,
反应温度:250C 、350C
(1)请写出锌和硫酸反应的离子方程式
(2)为表达锌和硫酸反应快慢,该学习小组设计了如下表格,请填充表格丁、戊、己三处。
| 编号 | 反应速率表达式的定义 | 反应速率表达式 | 反应速率单位 |
| ① | 单位时间内H+浓度的变化量 | V(H+) =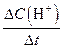 | mol / L.min |
| ② | 丁 | 戊 | 己 |
| ③ | 单位时间内生成H2标况下的体积 | V(H2) = 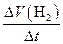 | L / min |
| 编号 | 锌的形状 | 锌的规格 | 硫酸的浓度 | 反应温度 | 实验设计的目的 |
| ① | 块状 | 纯锌 | 1mol/L | 250C | 实验①和②研究的目的是 庚 ; 实验②和③研究硫酸浓度对反应速率影响; 实验③和④研究锌的规格对反应速率影响; 实验④和⑤研究的目的是 癸 ; |
| ② | 颗粒状 | 纯锌 | 1mol/L | 250C | |
| ③ | 颗粒状 | 纯锌 | 辛 | 250C | |
| ④ | 颗粒状 | 壬 | 2mol/L | 250C | |
| ⑤ | 颗粒状 | 粗锌 | 2mol/L | 350C | |
| …… | |||||
查看答案和解析>>
科目: 来源:2010年广州市执信中学等四校联考高一第二学期期末考试化学试题 题型:实验题
(15分)化学世界奥妙无穷,物质之间的反应更是神秘莫测,善于透过现象看本质是学习化学、研究物质性质的基本能力。请我们一起进行探索。
(1)课堂上化学老师将干燥的氯气依次通过干燥红布条和潮湿的红布条,结果:干燥红布条无明显变化,而潮湿的红布条褪色。
①某学生立即发言:结论一、 ,
结论二、氯气与水反应生成的次氯酸具有漂白性。
②老师提示说:还需要补充一个实验才能得知结论二,该实验是
③请写出氯气与水反应的离子方程式
(2)某实验小组用铜和浓硝酸反应制备NO2,并收集一试管NO2气体,将集气瓶倒置于水槽中,并轻微振荡,发现一些典型现象,并对此现象进行探究。
①请写出NO2与水反应化学方程式,并用单线桥表示电子转移方向和数目
②该小组成员积极探讨,得出结论,NO2与水一定发生了化学反应,并设计了两个实验操作对产物进行了验证,得出产物是NO 和HNO3。请填写下表中的甲、乙、丙三处。
| 实验操作 | 实验现象 | 实验结论 |
| 用玻璃片将水槽中的试管口盖住,轻轻将试管取出 | 试管内约有2/3体积的水溶液,且无色 | NO2与水发生了化学反应,而不是溶于水 |
| 将试管正立,取下玻璃片 | 甲 | NO2和水反应生成了NO气体 |
| 乙 | 丙 | NO2和水反应生成了硝酸 |
查看答案和解析>>
科目: 来源:2009—2010学年聊城三中高一第二学期第四次阶段性测试化学试题 题型:实验题
(9分)目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论的。已知海水提镁的主要步骤如下:
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?
有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否正确(填是或否),并简述理由。
| | 是否正确 | 简述理由 |
| 学生甲的观点 | | |
| 学生乙的观点 | | |
| 学生丙的观点 | | |
A. |
B.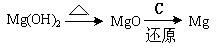 |
C. |
D. |
查看答案和解析>>
科目: 来源:2010届江苏启东中学高三考前辅导训练化学试题 题型:实验题
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
(1)称量样品所用的仪器为_____,将样品研细后再反应,其目的是_______。
(2)装置A的作用是________。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)滴定时,标准碘溶液所耗体积为_________mL。
判断滴定已达终点的现象是_______。
通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____。(填编号)
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
科目: 来源:2010年高考化学试题分项专题十五 化学实验 题型:实验题
(16分)某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其发扬进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaoH=_____________。
(2)反应Cl2+Na2SO3+2NaOH="2NaCl" + Na2SO4 +H2O中的还原剂为______________________-。
(3)吸收尾气一段时间后,吸收液(强碱性)吵肯定存在Cl-、OH-和SO42- 。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的CO2的影响)
①提出合理假设
假设1:只存在SO32- 假设2:既不存在SO32-也不存在ClO-
假设2:既不存在SO32-也不存在ClO-
假设3:_______ ______
______
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |  |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目: 来源:2010年高考化学试题分项专题十一 金属元素及其化合物 题型:实验题
(13分)某研究性学习小组在网上收集到如下信息: 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a. 边振荡盛有2%的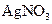 溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2ml乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配置过程中,溶液的pH增大
【提出假设】
假设1: 具有氧化性,能氧化Ag。
具有氧化性,能氧化Ag。
假设2: 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下 能氧化Ag。
能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出 ,验证了假设1的成立。请写出
,验证了假设1的成立。请写出 氧化Ag的离子方程式: 。
氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。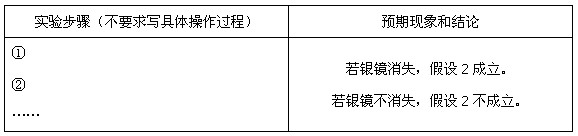
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论: 溶液中的
溶液中的 和
和 都氧化了Ag。你是否同意丙同学的结论,并简述理由: 。
都氧化了Ag。你是否同意丙同学的结论,并简述理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com