
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
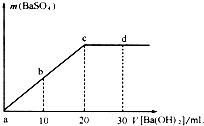 如图,常温下,向一定体积的0.1mol/L的硫酸溶液中逐滴加入浓度相同的Ba(OH)2溶液,生成沉淀的量与加入Ba(OH)2溶液的体积关系,a、b、c、d分别表示实验中不同阶段的溶液,下列有关说法中不正确的是
如图,常温下,向一定体积的0.1mol/L的硫酸溶液中逐滴加入浓度相同的Ba(OH)2溶液,生成沉淀的量与加入Ba(OH)2溶液的体积关系,a、b、c、d分别表示实验中不同阶段的溶液,下列有关说法中不正确的是查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打 ③蛋壳是否含碳酸钙 ④白酒中是否含甲醇
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com