
科目: 来源:09高考真题汇编—实验设计与评价 综合性实验 题型:推断题
(本题14分)铅是一种重金属,相对原子量为207。铅和铅的化合物有很多用途,如蓄电池等,但铅类化合物大多有毒,燃煤厂、金属冶炼厂等都有主要的铅污染源。铅一旦进入人体会累积,对人脑、肾脏和造血功能有损害。为了了解环境中的铅污染问题,小红他同学进行了如下的研究。
【小题1】在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,他设计了如下实验步骤:
(1)步骤中过滤需要的玻璃仪器是 、 和玻璃棒。
(2)步骤中a操作称为 ,缺少此操作,测得结果 (填“偏高”、“偏低”、或“无影响”)。
【小题2】通过研究,小红提出了一系列降低铅对环境污染的建议,下列建议中不恰当的是
| A.使用无铅汽油 |
| B.开发新的无铅燃料 |
| C.倡导使用铅蓄电池作动力的电动车 |
| D.燃煤电厂、金属冶炼厂的废气经除尘后排放。 |
查看答案和解析>>
科目: 来源:2013届新课标高三配套月考(一)化学试卷(B卷)(带解析) 题型:实验题
[2012·漳州质检](12分)2012年1月,广西河池龙江河段检测出重金属镉离子(Cd2+)含量超标,当地政府积极展开治污工作。聚合氯化铝可以将离子状态的镉固化,这是当前可采取治理镉污染的最有效方法。
已知:①煤矸石是煤矿在洗煤和选煤过程中大量排出的固体废弃物,煤矸石主要含Al2O3、SiO2及铁的氧化物。
②聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
以煤矸石为原料,采用铝盐水解絮凝剂,制得聚合氯化铝的工艺流程如下:
回答下列相关问题:
(1)向反应器中加入混合酸(20%的硫酸和盐酸)酸浸,其目的是 。
(2)流程中残渣1可用于工业上制取粗硅,写出该反应的化学方程式 。
(3)流程中残渣2的主要成分是 ,确认该成分中阳离子的方法是 。
(4)聚合氯化铝除镉的原理是生成了氢氧化铝胶体吸附镉离子,确定已生成氢氧化铝胶体的方法可利用胶体性质中的 。
常温下以溶液pH为横坐标,Cd2+离子的除去率为纵坐标,实验结果如图所示,由图可知,Cd2+离子的除去率最高时,溶液的c(OH-)= 。
查看答案和解析>>
科目: 来源:2012届广东省中山市高三上学期期末考试化学试卷 题型:实验题
(13分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂
亚氯酸钠(NaClO2),其工艺流程如下: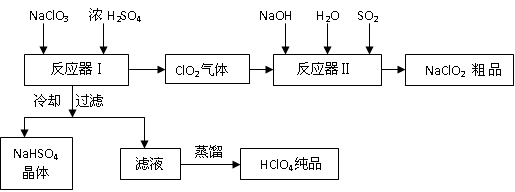
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成 NaClO2 ,请简要说明双氧水在反应中能代替SO2的原因是
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有 请写出工业上用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式
查看答案和解析>>
科目: 来源:2012届浙江省杭州市学军中学高三上学期第一次月考化学试卷 题型:实验题
(9分)工业上采用的一种污水处理方法如下:保持污水的pH在5.0 ~ 6.0之间,通过电解生成Fe(OH)3.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图如图所示.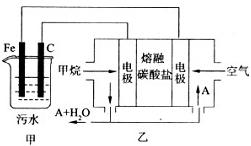
(l)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时应向污水中加入适量的
a.HCl b.CH3CH2OH c.Na2SO4 d. NaOH
(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是I.  ; II.
; II.
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.正极的电极反应是__________________________________;
(4)已知燃料电池中有1.6 g CH4参加反应,则C电极理论上生成气体 L (标准状况).
(5)若将装置中的甲部分换为如图所示的装置,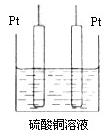
电解至CuSO4完全反应,继续电解后加入 可能恢复至原浓度。
查看答案和解析>>
科目: 来源:2011年普通高等学校招生全国统一考试化学卷(安徽) 题型:实验题
地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入 (写化学式)。
L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入 (写化学式)。
(2)右图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式 。t1时刻后,改反应仍在进行,溶液中N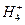 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
(3)改课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二: ;
假设二: ;
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的N 浓度可用离子色谱仪测定
浓度可用离子色谱仪测定
查看答案和解析>>
科目: 来源:2011届山东省临沂市高三上学期期中考试化学试题 题型:实验题
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)下列有关酸雨的说法正确的是 (填序号)。
A. SO2、NO2或CO2都会导致酸雨的形成
B. NO不溶于水,所以不会造成酸雨污染
C. 燃煤时鼓入足量空气,可以减少酸雨的产生
D. 采用清洁能源,可以减少酸雨的产生
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。
①下列实验方案适用于用右图所示装置制取所需SO2的是 (填序号)。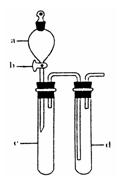
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
(填序号)。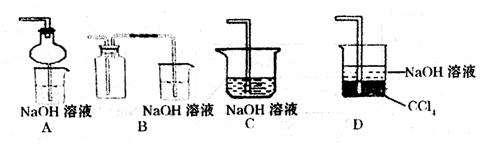
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性。为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是
查看答案和解析>>
科目: 来源:2010年湖南省浏阳一中高二上学期期中考试化学试题 题型:实验题
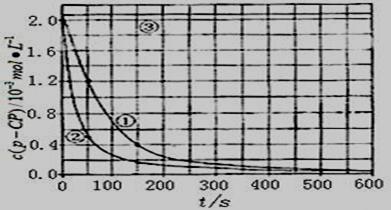
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 实验目的 | T/K | PH | c/10-3mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | | | | |
| ③ | | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目: 来源:2011届吉林省第一中学高三上学期第二次教学质量检测化学卷 题型:实验题
(15分)近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
①写出步骤(I)反应的化学方程式:
②写出步骤(III)反应的离子方程式:
(2)还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。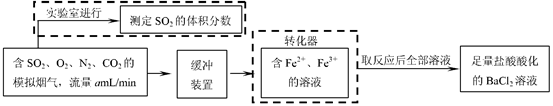

①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填
序号) 。(参考:还原性SO2 > I- >Br->Cl-)
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
查看答案和解析>>
科目: 来源:2012届浙江省杭州市学军中学高三上学期第一次月考化学试卷 题型:计算题
(12分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下
(1)合成塔中反应的化学方程式为 ;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了 。
(2)从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)
| A.过滤 | B.分液 | C.蒸馏 | D.结晶 |
 2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
 __。
__。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com