
科目: 来源:2012届江苏省泰州中学高三第一次学情调研测试化学试卷 题型:填空题
(14分)回收再利用储产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1)Ge2+与氧化剂H 2O2反应生成Ge4+,写出该反应的离子方程式 。
2O2反应生成Ge4+,写出该反应的离子方程式 。 (2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
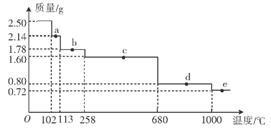
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。温度对GeCl4的水解率产生的影响如图1所示,其原因是 。为控制最佳的反应温度。实验时可采取的措施为  。
。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
查看答案和解析>>
科目: 来源:2012届江苏省泰州中学高三第一次学情调研测试化学试卷 题型:填空题
(10分)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。
(1)写出溶液B的溶质是 。
(2)参照以下框的形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作)。
(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成 Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①判断到达滴定终点的现象是 。
②某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移到25.00mL试样溶液,用0.0050mol·L-1KMnO4标准溶液滴定,达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是 。
查看答案和解析>>
科目: 来源:2012届山西省高三第一次阶段性诊断考试化学试卷 题型:填空题
(10分)胆矶(CuSO4?5H20)广泛用于电镀工艺,在医药上用做收敛剂、防腐剂和催吐剂。以下是用铜粉氧化法生产胆矾的流程图: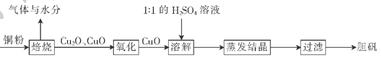
(1 )写出溶解过程中发生反应的离子方程式:____________
(2)1:1的H2SO4溶液是由l体积98%的H2SO4与1体积水混合而成。配制该硫酸所需的硅酸盐质仪器除玻璃棒外.还需要______、______。
(3)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成。假设焙烧后固体只含铜的氧化物.为检验该固体的成分.下列实验设计合理的是__________________(填字母)。
| A.加人稀H2SO4,若溶液呈蓝色,说明固体中一定有CuO |
| B.加人稀H2SO4,若有红色沉淀物生成,说明固体中一定有Cu2O |
| C.加人稀HNO3,若有无色气体(随即变成红棕色:)产生,说明固体中有Cu2O |
| D.加人稀HNO3,若固体全部溶解,说明固体中没有Cu2O |
查看答案和解析>>
科目: 来源:2012届陕西省长安一中高三开学第一次考试化学试卷 题型:填空题
(10分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图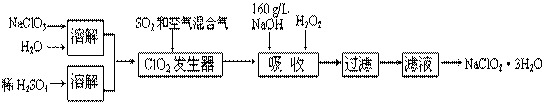
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283 K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
③HClO2在25 ℃时的电离常数与硫酸的第二步电离常数相当,可视为强酸。
(1)160 g/L NaOH溶液的物质的量浓度为____________________ 。若要计算该溶液的质量分数,还需要的一个数据是__________________ 。
(2)ClO2发生器中所发生反应的离子方程式为__________________________
(3)吸收塔中为防止产生NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2处,还可以选择的还原剂是( )(填序号)
| A.Na2O2 | B.Na2S | C.FeCl2 | D.KMnO4 |
查看答案和解析>>
科目: 来源:2010—2011学年福建省安溪一中、养正中学高一下学期期末联考化学试卷(理) 题型:填空题
(8分)四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+=== 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O ="==" TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________________________________________________________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在____________________范围。
(3)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________________________________(只要求写出一项)。
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| | TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目: 来源:2011届江苏省常州市横山桥高级中学高三上学期期中考试化学 题型:填空题
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
 :
: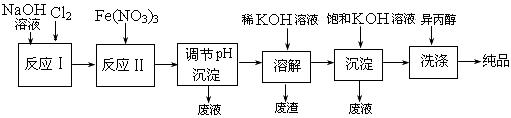
|
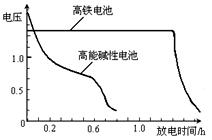
 ,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。查看答案和解析>>
科目: 来源:2011届江苏省常州市横山桥高级中学高三上学期期中考试化学 题型:填空题
(10分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸 氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液 中加入适量的对苯二酚等物质,其目的是 ▲ 。
中加入适量的对苯二酚等物质,其目的是 ▲ 。
(2)下列有关说法正确的是 ▲ 。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
查看答案和解析>>
科目: 来源:2011届重庆市西南师大附中高三第六次月考(理综)化学部分 题型:填空题
A是生产某新型工程塑料的基础原料之一,其组成元素为C、H、O,其分子结构模型如图所示(图中球与球之间连线代表化学键,不一定表示单键)。

(1)根据分子结构模型写出A的结构简式______________________________。
(2)写出反应类型:反应①、⑤分别属于_______________、_______________。
(3)B与F均能与溴水中的溴发生加成反应,F的结构简式为______________________。
写出反应⑥的化学方程式(注明必要的反应条件)______________________________。
(4)已知G有多种芳香族同分异构体,其中符合下列条件的同分异构体共有___________种。
①能与稀硫酸及NaOH溶液反应
②能发生银镜反应
③分子中有一个甲基
查看答案和解析>>
科目: 来源:2011届浙江省温州中学高三三月月考(理综)化学部分 题型:填空题
材料科学是近年来与化学有关的科学研究热点。某新型无机非金属材料K由两种非金属元素组成。它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。它是以中学化学中常见物质为原料来生产的。下图虚线框内的其它转化是为探究C的组成而设。G、F、H均为难溶于水的白色固体;图中C、H、K均为含A元素。其余物质均为中学化学中常见物质。
 |
查看答案和解析>>
科目: 来源:2010—2011学年辽宁省营口市高一上学期期末考试化学试卷 题型:填空题
(11分)
(1)(3分)工业上生产普通玻璃的主要原料是 、 、 (填俗名);
(2)(2分)写出通过化合反应制取Fe(OH)3的化学方程式: ;
(3)(2分)写出硅酸钠溶液在空气中变质的离子方程式: ;
(4)(2分)将CaMg3Si4O12改写为氧化物的形式: ;
(5)(2分)在氧化还原反应中,水是反应物,但水作氧化剂的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com