
科目: 来源:2012届江苏省南京市四校高三12月月考化学试卷 题型:填空题
(14分) 草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 ▲ 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如右图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A-B发生反应的化学方程式为: ▲ 。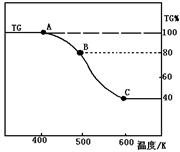
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: ▲ 、 ▲ ;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃.
的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸
亚铁锂的化学方程式为: ▲ 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,
写出相应的电极反应式:
正极 ▲ 、负极 ▲ 。
查看答案和解析>>
科目: 来源:2012届江苏省南京市四校高三12月月考化学试卷 题型:填空题
(14分)无水AlCl3易升华,可用作有机合成的催化剂等。工业 上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。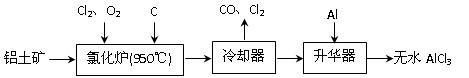
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 ▲ 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 ▲ 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 ▲ 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3) 的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 ▲ 、 ▲ 。
②AlCl3产品的纯度为 ▲ 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 ▲ 。
查看答案和解析>>
科目: 来源:2012届浙江省杭州市高复高三上学期11月份月考化学试卷 题型:填空题
氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g) 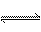 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数 。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________杂质。
查看答案和解析>>
科目: 来源:2012届浙江省绍兴一中高三上学期回头考试化学试卷 题型:填空题
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验(图中所用电极均为惰性电极): 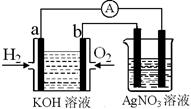
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
查看答案和解析>>
科目: 来源:2011-2012学年山东省日照一中高二上学期期中考试化学(理)试卷 题型:填空题
(10分)将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H 2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。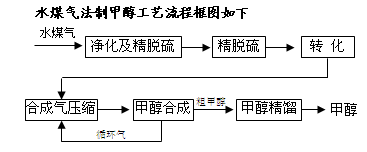
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)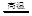 CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的 措施是 ;(填字母代号)
措施是 ;(填字母代号)
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
 CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4[ |
 。
。查看答案和解析>>
科目: 来源:2012届浙江省苍南县银库高中、灵溪二中高三上学期期中联考化学试卷 题型:填空题
(12分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: 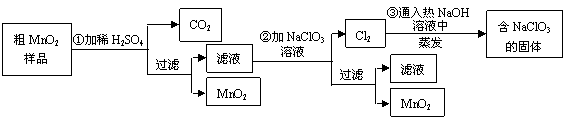
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式 +
+ ClO3-+
ClO3-+ =
= MnO2+
MnO2+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要 mol NaClO3
查看答案和解析>>
科目: 来源:2012届福建省南安一中高三上学期期中考试化学试卷 题型:填空题
(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀 法生产Fe3O4的工艺:
法生产Fe3O4的工艺:
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384,6384/152=42请回答下列问题:
(1)铁的常见氧化物有 ;
(2)Fe3O4与稀硝酸反应的离子方程式是 ,检验反应后的溶液中含Fe3+的方法 ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是: ;
(4)生产中可获得的副产品是 ,提取该副产品的操作顺序是 (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为 L/h(假设反应在标准状态下进行,空气中O2占20%)。
查看答案和解析>>
科目: 来源:2011-2012学年重庆市重庆一中高二上学期期中考试化学试卷 题型:填空题
(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示: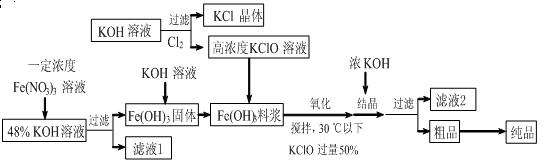
(1)上述氧化过程中,发生反应的离子方程式是: ,控制反应温度30℃以下的原因是: 。
(2)结晶过程中加入浓KOH溶液的作用是: 。
(3)根据图1、图2回答:为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。
查看答案和解析>>
科目: 来源:2011-2012学年重庆市重庆一中高二上学期期中考试化学试卷 题型:填空题
(10分)利用天然气合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是 。
(2)图中CH4的第一次转化过程中的化学方程式是 。
(3)整个流程有三处循环,一是K2CO3(aq)循环,二是N2和H2循环,三是 (填化学式)循环。
(4)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)。
a.熵增原理 b.勒夏特列原理 c.酸碱中和原理
查看答案和解析>>
科目: 来源:2012届江西省南昌一中高三11月月考化学试卷 题型:填空题
(7分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: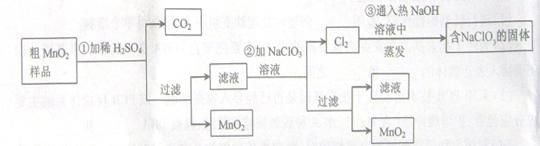
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式(要配平)
+ ClO3-+ = MnO2 + Cl2↑+ 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要 mol NaClO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com