
科目: 来源:2012届广东省梅州中学高三第二次月考理科综合试题(化学部分) 题型:实验题
(16分)我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下: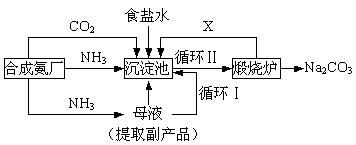

沉淀池中四种盐在不同温度下的溶解度(g / 100 g水)表
 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目: 来源:2012届江苏省苏州市苏苑高级中学高三上学期10月份月考化学试卷 题型:实验题
(12分)高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH主要的生产流程如下:
(1)写出反应①的离子方程式 。
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
上左图为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
右图为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
①工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
。
若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
(4)K2FeO4在水溶液中易水解:4FeO42—+10H2O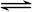 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
| A.H2O | B.CH3COONa、异丙醇 | C.NH4Cl、异丙醇 | D.Fe(NO3)3、异丙醇 |
查看答案和解析>>
科目: 来源:2012届江苏省苏州市苏苑高级中学高三上学期10月份月考化学试卷 题型:实验题
(12分)硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下: 
已知几种盐的溶解度随温度变化的曲线如右图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品I的化学反应方程式为________________________________。
实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为_______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: 。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
查看答案和解析>>
科目: 来源:2011届江苏省泰州中学高三上学期期中考试化学试题 题型:实验题
I 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤: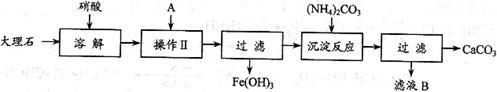
(1)用硝酸溶解大理石时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
、 。
(2)操作Ⅱ的目的是  , 若A为溶液,则A可以是 。
, 若A为溶液,则A可以是 。
(3)写出加入碳酸铵所发生反应的离子方程式:  。
。
II 以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 
(4)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
(5)下列有关说法正确的是 。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
查看答案和解析>>
科目: 来源:2011届宁夏银川一中高三上学期第五次月考(理综)化学部分 题型:实验题
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为: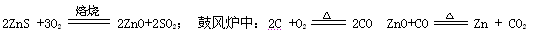
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2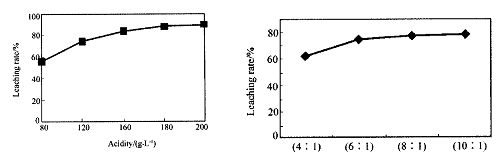
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
查看答案和解析>>
科目: 来源:2011届上海市吴淞中学高三上学期期中考试化学试卷 题型:实验题
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: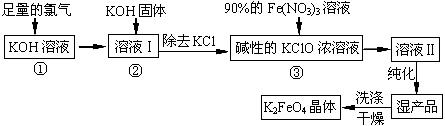
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式
,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
查看答案和解析>>
科目: 来源:2011届江苏赣榆高中高三第一次月考化学卷 题型:实验题
(12分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: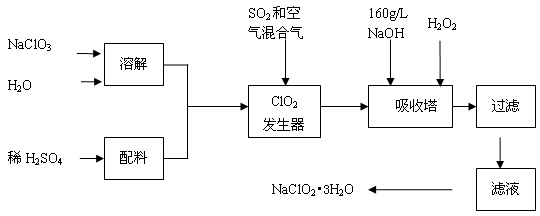
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。回答下列问题:
(1)发生器中发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其目的是 。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。以下还可以选择的还原剂是 (选填序号)。
a. Na2O2 b. Na2S c.FeCl2
(4)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
查看答案和解析>>
科目: 来源:2012届江苏省阜宁、大丰、栟茶高级中学高三第二次调研联考化学试卷 题型:问答题
(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤________________________________________________________________________。
⑥_______________________________________________________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:_______________________________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________
_____________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;
另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10?39)。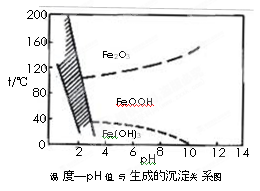
下列说法正确的是______________(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_____________
_________________________________________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。
查看答案和解析>>
科目: 来源:2012届江苏省涟水中学高三12月阶段性测试化学试卷(带解析) 题型:填空题
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下: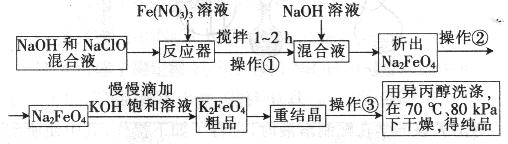
试回答下列问题
(1)操作①后的混合液中加入NaOH溶液的作用是: 。
最后用异丙醇洗涤产品的目的是 。
(2) 操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _____________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响(下图甲),当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)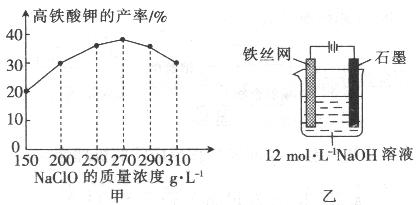
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为 。
查看答案和解析>>
科目: 来源:2012届江苏省涟水中学高三12月阶段性测试化学试卷(带解析) 题型:填空题
MnSO4·H2O在工业、农业等方面有广泛的应用。工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下: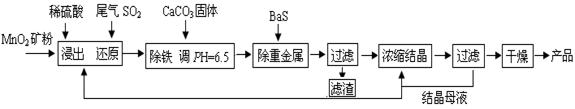
已知: 常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是 。
(2)除铁发生的离子反应方程式为 。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= mol/L。
(4)已知MnSO4·H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,则在该条件下硫酸锰晶体分解反应的化学方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com