
科目: 来源:2010年上海市控江中学高一第二学期期中考试化学试卷 题型:计算题
(8分)接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。某硫酸厂每天排放的1万米3(已换算成标准状况)尾气中含0.2%(体积百分数)的SO2。
(1)若用生石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克生石膏?
(2)若用氨水处理,最少需要标况下的氨气多少升?最多需要标准状况下的氨气多少升?
查看答案和解析>>
科目: 来源:2010年江苏省淮州中学高二下学期期末考试化学 题型:计算题
(12分)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)原子序数为22基态钛原子的核外电子排布式为 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 。
查看答案和解析>>
科目: 来源:2010年江苏省淮州中学高二下学期期末考试化学 题型:计算题
(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g)+1/2O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时
v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
查看答案和解析>>
科目: 来源:2010届湖北省黄冈中学高三11月月考化学测试卷 题型:计算题
(8分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O═ +2Fe2++4H+
+2Fe2++4H+
Cr2 +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式 。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%在硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
查看答案和解析>>
科目: 来源:2008年普通高等学校招生统一考试化学试题(上海卷) 题型:计算题
生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO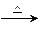 CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1)原混合气体中甲烷的物质的量是____________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
查看答案和解析>>
科目: 来源:2012届山东省菏泽学院附中高三5月高考冲刺理科综合化学试卷(带解析) 题型:问答题
(16分)纳米TiO2具有独特的光催化性、优异的颜色效应以及紫外线屏蔽等功能,在光催化剂、化妆品、抗紫外线吸收剂、功能陶瓷、气敏传感器件等方面具有广阔的应用前景。工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下: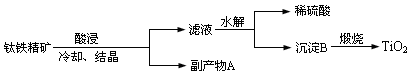
(1)写出硫酸酸浸溶解钛铁精矿的离子方程式 ,酸浸时为了提高浸出率,可以采取的措施为 。
(2)钛铁精矿后冷却、结晶得到的副产物A为 ,结晶析出A时,为保持较高的酸度不能加水,其原因可能为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是 。
(4)上述工艺流程中体现绿色化学理念的是 。
(5)工业上将TiO2和炭粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式: 。
查看答案和解析>>
科目: 来源:2012届广东省连州市连州中学高三12月月考理科综合化学试卷(带解析) 题型:问答题
(16分)工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:
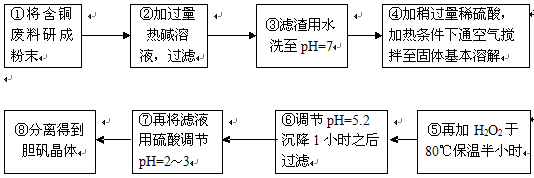
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目: 来源:2012届广东省揭阳第一中学高三上学期摸底考试理综卷(化学部分) 题型:问答题
(18分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿(主要成份MnO2)制备高锰酸钾的流程图。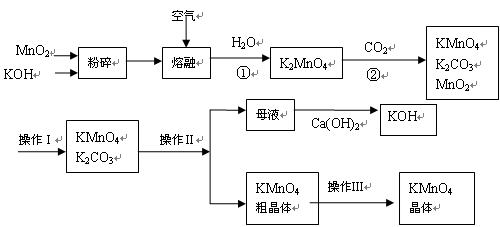
(1)软锰矿粉碎的目的 。
软锰矿、KOH混合物在空气加热熔融反应生成K2MnO4的化学方程式为:
。操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。
以上生产流程中可循环利用的物质是Ca(OH)2、CO2、 、 。
工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,电解K2MnO4溶液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性。简述实验操作、现象及相关结论:
。
查看答案和解析>>
科目: 来源:2013届辽宁省沈阳市第二十中学高三高考领航考试(二)化学试卷(带解析) 题型:填空题
)【化学—选修化学与技术】
工业上以磷肥生产形成的副产物石膏(CaSO4·2H2O)与焦炭为原料可生产硫酸,同时
可以得到硫酸钾肥料和氯化钙水合物储热材料。以下是有关的工艺流程示意图。
试回答:
(1)写出方程式:反应Ⅰ___________________________________,
(2)写出方程式:反应Ⅱ______________________________________。
(3)请根据下表和化学平衡知识,分析工业上制硫酸中SO2的催化氧化的适宜条件是
____________________________________。
表Ⅰ:
 压 强 / M Pa 压 强 / M Pa转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
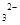 的方法是___________________________________。
的方法是___________________________________。 )是目前常用的无机储热材料,选择的依据是___________ (填序号)。
)是目前常用的无机储热材料,选择的依据是___________ (填序号)。查看答案和解析>>
科目: 来源:2012-2013学年湖南省师大附中高一上学期期末考试化学试卷(带解析) 题型:填空题
(1)工业上生产玻璃、水泥都要用到的原料是 。(选填石灰石、粘土、石英、石膏)
(2)漂白粉由氯气和石灰乳反应生成,其有效成分是 。(填化学式)
(3)测定硅铁合金中硅的含量可以有两种方法,其一是将合金粉末加入足量的稀硫酸中,其二是将合金粉末加入足量的 中,都可以通过收集生成气体并测定其体积数据而确定硅含量。写出第二种方法的反应离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com