
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目: 来源: 题型:单选题
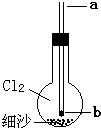 如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠.从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应.
如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠.从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应.查看答案和解析>>
科目: 来源: 题型:单选题
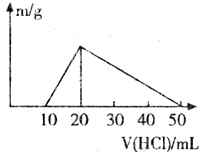 向100mL0.1mol.L-1的AlCl3溶液中,加入1mol.L-1的NaOH溶液VmL后,再滴加1mol.L-1盐酸.滴加盐酸的体积(横坐标)与生成沉淀的质量(纵坐标)如下图所示的关系,则加入的NaOH溶液的体积为
向100mL0.1mol.L-1的AlCl3溶液中,加入1mol.L-1的NaOH溶液VmL后,再滴加1mol.L-1盐酸.滴加盐酸的体积(横坐标)与生成沉淀的质量(纵坐标)如下图所示的关系,则加入的NaOH溶液的体积为查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com