
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
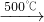 Na2SO4+2HCl↑
Na2SO4+2HCl↑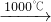 Na2S+2CO2↑
Na2S+2CO2↑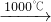 Na2CO3+CaS
Na2CO3+CaS| x | y | z |
查看答案和解析>>
科目: 来源: 题型:解答题
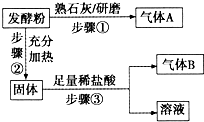 发酵粉是一种生产面制品和膨化食品的化学膨松剂,由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成.某研究性学习小组为探究不同品牌发酵粉的化学成分,进行如下实验:
发酵粉是一种生产面制品和膨化食品的化学膨松剂,由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成.某研究性学习小组为探究不同品牌发酵粉的化学成分,进行如下实验:| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 1.取适量样品溶于稀盐酸后,将溶于分成两份 | ----- |
| 2.______ | ______ |
| 3.______ | ______ |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
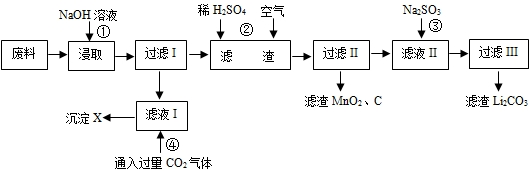
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com