
科目: 来源: 题型:解答题
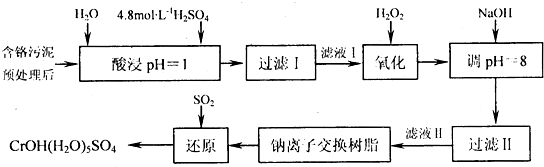
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | 4.7 | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目: 来源: 题型:解答题
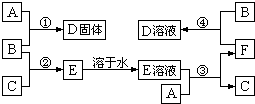 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E的溶液是无色的.请回答:
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知单质A是当今世界产量最大的金属,E的溶液是无色的.请回答:查看答案和解析>>
科目: 来源: 题型:填空题
 2Fe+3CO2.其中,Fe2O3________( 填“被氧化”或“被还原”),CO作________(填“氧化剂”或“还原剂”).在该反应中,若消耗了1mol Fe2O3,则生成________mol Fe.
2Fe+3CO2.其中,Fe2O3________( 填“被氧化”或“被还原”),CO作________(填“氧化剂”或“还原剂”).在该反应中,若消耗了1mol Fe2O3,则生成________mol Fe.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目: 来源: 题型:单选题
 Fe3O4+4 H2
Fe3O4+4 H2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com