
科目: 来源: 题型:
| 加热前的质量 | 加热后的质量 | |
| m0(坩埚) | m1(坩埚+晶体) | m2(坩埚+无水硫酸铜) |
| 18.269g | 19.420g | 19.011g |
查看答案和解析>>
科目: 来源: 题型:
| 剩余固体的质量 | 原始固体质量 |
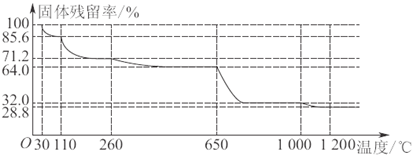
查看答案和解析>>
科目: 来源: 题型:

| 称量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 质量(g) | m1 | m2 | m3 | m4 | m4 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:阅读理解
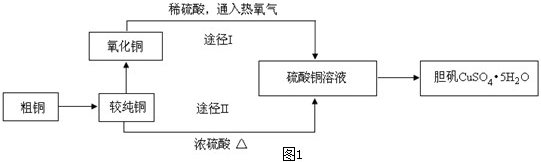
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 50.0g | 70.0g | 540.0g |
| 反应后 | 45.0g | 74.5g | 540.0g |
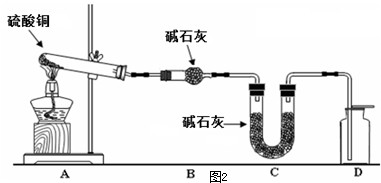
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| △ |
| ||
查看答案和解析>>
科目: 来源: 题型:
| A、加热时间过长,固体部分变黑 | B、坩锅内附有不挥发杂质 | C、晶体不纯,含有不挥发杂质 | D、加热过程中有少量晶体溅出 |
查看答案和解析>>
科目: 来源: 题型:
| A、测定硫酸铜晶体中结晶水含量,失水后的硫酸铜置于空气中冷却后再测质量 | B、测定中和热实验中,所使用的NaOH稀溶液的物质的量浓度稍大于稀盐酸 | C、配制一定物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水 | D、用标准盐酸滴定未知浓度的氢氧化钠溶液,开始时俯视读数,终点时仰视读数 |
查看答案和解析>>
科目: 来源: 题型:
| A、将坩埚放在石棉网上进行加热 | B、实验中先称量硫酸铜晶体的质量然后再研磨 | C、加热温度过高,会使一部分硫酸铜分解,导致测定结果偏高 | D、坩埚在加热前未完全干燥,导致测定的结果偏低 |
查看答案和解析>>
科目: 来源: 题型:
| A、Cu(NO3)2?nH2O | B、MgCl2?nH2O | C、MgSO4?nH2O | D、FeSO4?nH2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com