
科目: 来源: 题型:
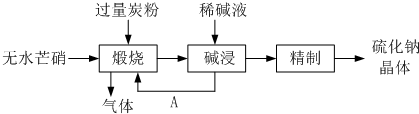
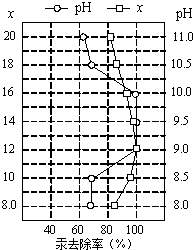 (4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如图所示).为使除汞效果最佳,应控制的条件是查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
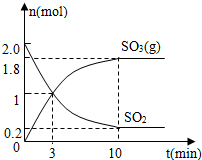 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题: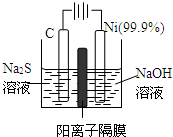
查看答案和解析>>
科目: 来源: 题型:
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
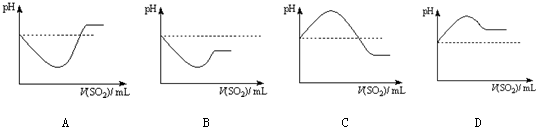
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
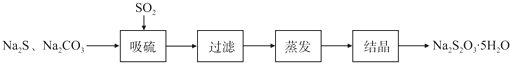
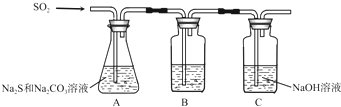
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, |
样品含NaCl | |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, |
样品含NaOH |
查看答案和解析>>
科目: 来源: 题型:
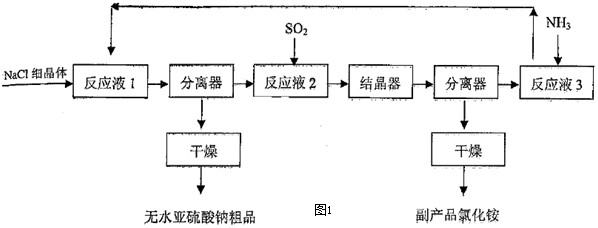
| 原料 | 理论值 | 实际值 | 利用率 |
| SO2 | 50.79 | 54.4 | 93.36% |
| NaCl | 92.86 | 101.0 | 91.94% |
| NH3 | 26.98 | 30.5 | 88.46% |
| 副产品NH4Cl | a | 87.1 | -------- |
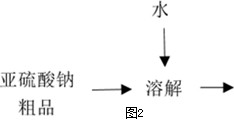
查看答案和解析>>
科目: 来源: 题型:
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室温下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
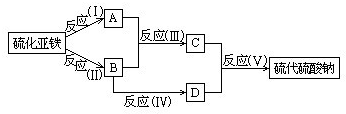
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com