
科目: 来源: 题型:
| A、水玻璃可用作木材防火剂 | B、二氧化硅是制造光导纤维的材料 | C、石英是制造太阳能电池的常用材料 | D、石灰石和纯碱均是生产普通玻璃的原料 |
查看答案和解析>>
科目: 来源: 题型:
| A、青石棉是一种硅酸盐原料 | B、青石棉中含有一定量的石英晶体 | C、青石棉的化学组成可表示为:Na2O?3FeO?Fe2O3?8SiO2?H2O | D、1mol青石棉能使1molHNO3被还原 |
查看答案和解析>>
科目: 来源: 题型:
| A、生活中常见的石英玻璃、普通玻璃、陶瓷都属于硅酸盐产品 | B、腌制火腿时,添加少量NaNO2,是为了使火腿肉的味道更加可口 | C、我国禁止汽车使用含铅汽油,其主要原因是铅资源短缺 | D、肥皂与纯碱均可以去污,但去污的原理不同 |
查看答案和解析>>
科目: 来源: 题型:
| A、天然气和液化石油气的主要成分都是甲烷 | B、甘氨酸和丙氨酸脱水,最多可生成3种二肽 | C、古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 | D、K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于自来水的净化和杀菌消毒 |
查看答案和解析>>
科目: 来源: 题型:
| A、辉石、斜长石及橄榄石均属于硅酸盐矿 | B、斜长石的氧化物形式可表示为:K2O?Al2O3?3SiO2 | C、月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 | D、橄榄石中铁为+2价 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
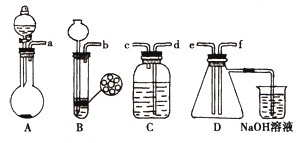 已知实验室制取H2S的实验原理为FeS(块状)+H2SO4═FeSO4+H2S↑.
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4═FeSO4+H2S↑.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com