
科目: 来源: 题型:
A、工业制备金属钠:2NaCl
| ||||
B、工业制备金属镁:MgCl2
| ||||
C、工业制备氯气和烧碱:2NaCl+2H2O
| ||||
D、工业制备金属铝:2AlCl3
|
查看答案和解析>>
科目: 来源: 题型:
A、2NaCl(熔融)
| ||||
B、Al2O3+3H2
| ||||
C、Fe3O4+4CO
| ||||
D、2HgO
|
查看答案和解析>>
科目: 来源: 题型:
| A、由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属 | ||
| B、利用牺牲阳极保护法保护钢铁时,钢铁作正极 | ||
C、少量铁溶于稀硝酸,反应的离子反应为:Fe+4H++N
| ||
| D、纳米Fe、纳米Cu的化学活性都比原来增强,两者都能与盐酸反应生成氢气 |
查看答案和解析>>
科目: 来源: 题型:
| A、工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质 | B、醇和酚中都有羟基,都可以和氢氧化钠溶液反应 | C、二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应 | D、氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只是生成盐和水 |
查看答案和解析>>
科目: 来源: 题型:
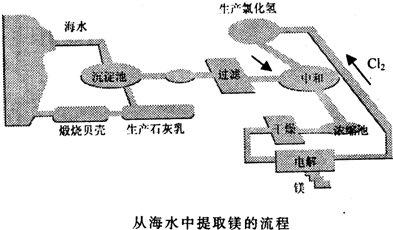
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
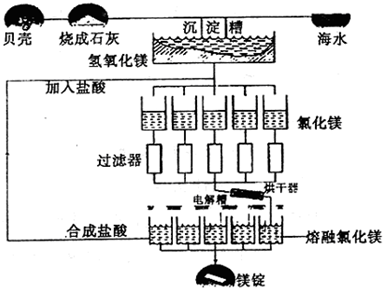
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com